
| A.当有0.2mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:C1->CN- |
科目:高中化学 来源:不详 题型:单选题
| A.该反应从电子转移角度看,与SO2 + 2H2S =" 3S" + 2H2O是同一反应类型 |
| B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol |
| C.该反应中,氧元素氧化了硫元素 |
| D.该反应中,Cu2S既是还原剂又是氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… |
| ② | C12、FeBr2 | FeC13、FeBr3 |
| ③ | MnO4-…… | C12、Mn2+…… |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
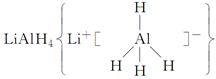 、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。
、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。| A.LiH与D2O反应,所得氢气的摩尔质量为4 g·mol-1 |
| B.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| C.LiAlH4溶于适量水得无色溶液,则化学方程式可表示为LiAlH4+2H2O=LiAlO2+4H2↑ |
| D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.氧化性:KClO3>H3PO4 | B.氧化性:H3PO4>KClO3 |
| C.还原性:PH3>X | D.还原性:X>PH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
| B.反应中氧化产物是N2O |
| C.反应过程中转移的电子数为8mol电子 |
| D.氧化产物和还原产物的物质的量之比为4∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述反应是放热反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.该反应氧化剂与还原剂物质的量之比为6:5 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com