
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:不详 题型:单选题
| A.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.通入22.4 L SO2参加反应时,有2NA个电子发生转移 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O3和O2是同素异形体 | B.H2O既不是氧化剂也不是还原剂 |
| C.氧化性:I2>O2 | D.反应生成1mol I2时转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当有0.2mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:C1->CN- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 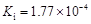 |  |  |  |
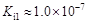 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①中红色褪去的原因是KMnO4将SCN-氧化 |
| B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+ |
| C.②中红色褪去的原因是SO2将SCN-还原 |
| D.SCN-在适当条件下可失去电子被氧化为(SCN)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NaNO2 B.氧化性:NaNO2
NaNO2 B.氧化性:NaNO2 I2
I2 NO D.还原性:I2
NO D.还原性:I2 HI
HI查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com