
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:不详 题型:实验题
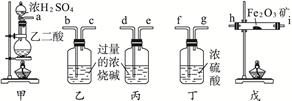
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸 | → | 用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL |
| A.①②⑤⑥ | B.②④⑤⑥⑦ | C.②①⑥⑦ | D.②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
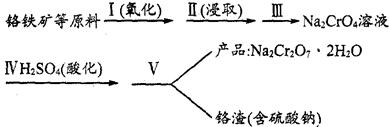
 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。| A.升高温度 | B.将原料粉碎 | C.增加纯碱的用量 | D.通入过量的空气 |
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② | | |
| ③ | | |
| ④ | | |
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
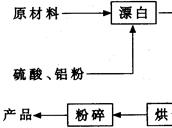
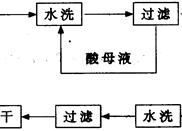
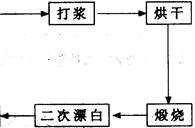
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
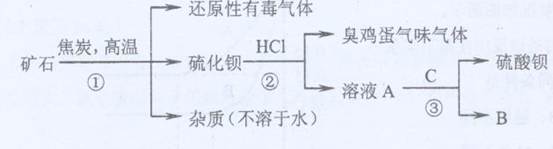 (1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
(1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4mol | B.6mol | C.8mol | D.16mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
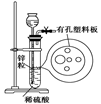
| A.①③⑤ | B.①②③ | C.④⑤⑥ | D.①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com