
| 配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸 | → | 用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL |
| A.①②⑤⑥ | B.②④⑤⑥⑦ | C.②①⑥⑦ | D.②④⑤⑥ |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源:不详 题型:实验题
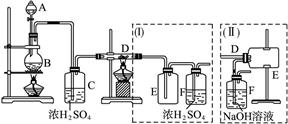
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
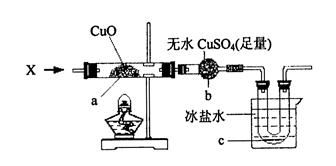
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.①②③④⑥⑦⑤ | B.②①③④⑥⑦⑤ |
| C.①③②⑥④⑤⑦ | D.③②①⑥④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制0.1 mol·L-1 100 mL的CuSO4溶液 |
| B.蒸发 |
| C.测定硫酸铜晶体中结晶水的含量 |
| D.萃取、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com