



科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | I1 | I2 | I3 | I4 | …… |
| R | 740 | 1 500 | 7 700 | 10 500 | …… |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 键:
键:
 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。 的价层电子排布图为_____
的价层电子排布图为_____查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
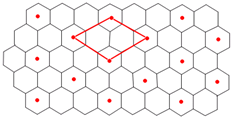
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.四种元素位于同一周期 | B.氢化物的稳定性:H2Y>HZ |
| C.离子的氧化性:aW3+>bX+ | D.a+3=c-2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铊是易导电的银白色金属 | B.能生成+3价离子化合物 |
| C.T1(OH)3是两性氢氧化物 | D.Tl的失电子能力比Al强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.气态氢化物的稳定性:N>R |
| B.Z的最高价氧化物对应的水化物能溶于稀氨水 |
| C.Y和R形成的化合物既含离子键又含共价键 |
| D.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com