
【题目】下列有机物命名正确的是
A. 1,3,4—三甲苯B.
1,3,4—三甲苯B.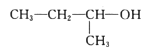 2—甲基—1—丙醇
2—甲基—1—丙醇
C.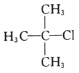 2—甲基—2—氯丙烷D.
2—甲基—2—氯丙烷D.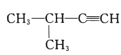 2—甲基—3—丁炔
2—甲基—3—丁炔
【答案】C
【解析】
A.苯的同系物在命名时,要从简单的支链开始对苯环上的碳原子进行编号,使支链的为位次和最小,故三个甲基分别在1、2、4号碳原子上,名称为:1,2,4-三甲苯,A错误;
B.醇命名时,选含官能团的最长的碳链,故主链上有4个碳原子,从离官能团近的一端给主链上的碳原子进行编号,则-OH在2号碳原子上,故名称为2-丁醇, B错误;
C.卤代烃命名时,选含官能团的最长的碳链,从离官能团近的一端给主链上的碳原子进行编号,氯原子在2号碳原子上,且在2号碳原子上有一个甲基,名称为2-甲基-2-氯丙烷,C正确;
D.炔烃命名时,选含官能团的最长的碳链,主链上有4个碳原子,故为丁炔,从离官能团近的一端给主链上的碳原子进行编号,则碳碳三键在1号和2号碳原子之间,在3号碳原子上有一个甲基,故名称为3-甲基-1-丁炔,D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fex(OH)y(SO4)z](其中Fe元素为+ 3价)是一种新型高效絮凝剂。一种利用废铁屑(含Fe和少量Al2O3、Fe2O3)生产碱式硫酸铁的工艺流程如下:
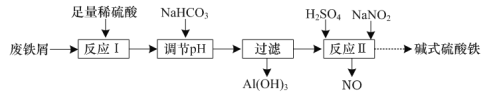
下列说法正确的是
A.x、y、z一定符合关系式:x=y=z
B.“过滤”所得滤液中只含溶质FeSO4
C.“反应Ⅰ”中包含的反应类型有置换反应、化合反应和复分解反应
D.在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若有11.2 L(标准状况)的O2参与反应,则相当于节约2 mol NaNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是
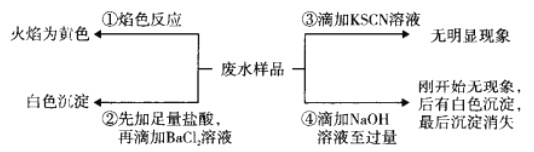
A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示。
化学反应 | 化学平衡常数 | 温度(℃) | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
(1)下列措施能使反应③的平衡体系中![]() 增大的是__
增大的是__
A.将H2O(g)从体系中分离出去 B.恒容时充入He(g),使体系压强增大
C.升高温度 D.恒容时再充入1molH2(g)
(2)T℃时,反应③在恒容密闭容器中充入1molCO2和nmolH2,混合气体中CH3OH的体积分数与氢气的物质的量的关系如图1所示。图1中A、B、C三点对应的体系,CO2的转化率最大的是___(填字母)。
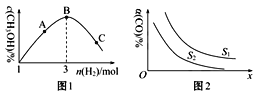
(3)工业上也用合成气(H2和CO)合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) ΔH<0,在10L的恒容密闭容器中充入H2和C物质的量比为2:1,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) ΔH<0,在10L的恒容密闭容器中充入H2和C物质的量比为2:1,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是___。
②300℃时,氢气的物质的量随时间变化如表所示
反应时间/min | 0 | 1 | 4 | 5 |
H2/mol | 8 | 5.4 | 4 | 4 |
在该温度下,上述反应的平衡常数为___。若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH,保持温度和容器体积不变,则平衡会___(填“正向移动”“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
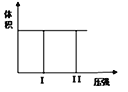
【题目】(I)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) ![]() 2Z(g), 若把2molX和1molY充入该容器时,处于状态I,反应在绝热条件下达到平衡时处于状态II(如图),则该反应的△H___0;(填:“<,>,=”)。该反应在___(填:高温或低温)条件下能自发进行。
2Z(g), 若把2molX和1molY充入该容器时,处于状态I,反应在绝热条件下达到平衡时处于状态II(如图),则该反应的△H___0;(填:“<,>,=”)。该反应在___(填:高温或低温)条件下能自发进行。
(II)已知2A2(g)+B2(g)![]() 2C(g) △H=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量bkJ。请回答下列问题:
2C(g) △H=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量bkJ。请回答下列问题:
(1)若将反应温度升高到700℃,反应的平衡常数将___(填“增大”、“减小”或“不变”)。
(2)若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系(用代数式表示)___。
(3)能说明该反应已经达到平衡状态的是(_____)
a.V(C)=2V(B2) b.容器内气体压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是(_____)
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d___b(填>、=、<)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如下图所示。
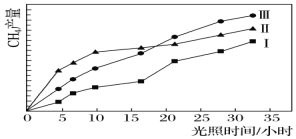
(1)在0~30小时内,CH4的平均生成速率vⅠ、vⅡ、vⅢ从大到小的顺序为__________;反应开始后的12小时内,在第________种催化剂作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ·mol-1。
①在下列坐标图中,画出反应过程中体系能量变化图(进行必要标注)。________;

②将等物质的量的CH4和H2O(g)充入1 L恒容密闭反应器,某温度下反应达平衡,平衡常数K=27,此时测得CO的物质的量为0.10 mol,则CH4的平衡转化率为________(结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1,写出由CO2生成CO的热化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动从海水中提取金属锂的装置,示意图如图所示。该装置工作时,下列说法正确的是
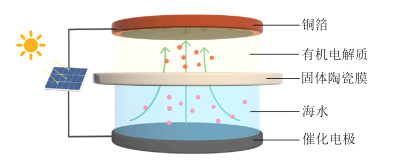
A.铜箔上的电势比催化电极上的高
B.海水的pH变大
C.若转移1mol电子,理论上铜箔增重7g
D.固体陶瓷膜可用质子交换膜代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1909年德国化学家哈伯在实验室首次合成氨,合成氨技术的创立开辟了人工固氮的重要途径,其研究正是基于科学化学反应原理的指导。
(1)已知298K时,N2(g)+3H2(g)![]() 2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
(2)目前处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1=﹣92.4kJ/mol
2NH3(g) ΔH1=﹣92.4kJ/mol
2H2(g)+ O2(g)![]() 2H2O(l) ΔH2=﹣571.6kJ/mol
2H2O(l) ΔH2=﹣571.6kJ/mol
2N2(g)+ 6H2O(l)![]() 4NH3(g)+3O2(g) ΔH3
4NH3(g)+3O2(g) ΔH3
则ΔH3=___kJ/mol。
(3)合成氨反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

①t4时刻,体系中是什么条件发生了变化?t4____。
②下列时间段中,氨的百分含量最高的是____。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
(4)在容积为1L的密闭装置中,充入4mol合成气(N2、H2),在400℃时反应,N2的体积分数随时间变化关系如图所示。
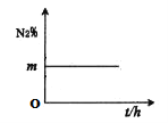
①N2、H2的投料比为____。
②反应达到平衡后,测得装置中H2的体积分数为25%,则400℃时,合成氨反应的平衡常数为___(可用分数表示)。
③在恒温恒容下,N2、H2、NH3的投料为1.5mol、0.5mol、1mol,平衡时H2的体积分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com