
����Ŀ��1909��¹���ѧ�ҹ�����ʵ�����״κϳɰ����ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о����ǻ��ڿ�ѧ��ѧ��Ӧԭ����ָ����
��1����֪298Kʱ��N2��g��+3H2��g��![]() 2NH3��g������H=�C92.2kJ/mol����S=�C198.2J/(K��mol)������ݷ�Ӧ���еķ����ۺ��оݣ������ºϳɰ���Ӧ___����ܡ����ܡ����Է����С�
2NH3��g������H=�C92.2kJ/mol����S=�C198.2J/(K��mol)������ݷ�Ӧ���еķ����ۺ��оݣ������ºϳɰ���Ӧ___����ܡ����ܡ����Է����С�
��2��Ŀǰ�����о��εĻ�ѧ�̵��·�����N2�ڴ���������ˮ�������·�Ӧ��
��֪��N2(g)+ 3H2(g)![]() 2NH3(g) ��H1=��92.4kJ/mol
2NH3(g) ��H1=��92.4kJ/mol
2H2(g)+ O2(g)![]() 2H2O(l) ��H2=��571.6kJ/mol
2H2O(l) ��H2=��571.6kJ/mol
2N2(g)+ 6H2O(l)![]() 4NH3(g)+3O2(g) ��H3
4NH3(g)+3O2(g) ��H3
����H3=___kJ/mol��
��3���ϳɰ���Ӧ��һ�ܱ������з�������ͼ��ijһʱ��η�Ӧ�����뷴Ӧ���̵Ĺ�ϵ����ͼ��

��t4ʱ�̣���ϵ����ʲô���������˱仯��t4____��
������ʱ����У����İٷֺ�����ߵ���____��
A��0��t1 B��t2��t3 C��t3��t4 D��t4��t5
��4�����ݻ�Ϊ1L���ܱ�װ���У�����4mol�ϳ�����N2��H2������400��ʱ��Ӧ��N2�����������ʱ��仯��ϵ��ͼ��ʾ��
��N2��H2��Ͷ�ϱ�Ϊ____��
�ڷ�Ӧ�ﵽƽ����װ����H2���������Ϊ25%����400��ʱ���ϳɰ���Ӧ��ƽ�ⳣ��Ϊ___(���÷�����ʾ)��
���ں��º����£�N2��H2��NH3��Ͷ��Ϊ1.5mol��0.5mol��1mol��ƽ��ʱH2���������Ϊ___��
���𰸡��� +1530.0 ��Сѹǿ A 1:1 25/32 25%
��������
��1�����ݹ�ʽ��H��T��S���㣻
��2�����ݸ�˹���������㻯ѧ��Ӧ���ʱ䣻
��3��������������Է�Ӧ���ʺ�ƽ��״̬��Ӱ����ͼ��������
��4����������ʽ���⡣
(1)����Ӧ�������С�ķ��ȷ�Ӧ����H��T��S���C92.2+0.1982��298��0�����Գ����ºϳɰ���Ӧ���Է����У��ʴ�Ϊ���ܣ�
��2����֪����N2(g)+ 3H2(g)![]() 2NH3(g) ��H1=��92.4kJ/mol
2NH3(g) ��H1=��92.4kJ/mol
��2H2(g)+ O2(g)![]() 2H2O(l) ��H2=��571.6kJ/mol
2H2O(l) ��H2=��571.6kJ/mol
���ݸ�˹���ɣ���Ӧ2N2(g)+ 6H2O(l)![]() 4NH3(g)+3O2(g)�����Ǣ١�2-3���ڵõ�������Ӧ���ʱ䣩��H=��-92.4kJmol-1����2-3��-571.6kJmol-1��=1530kJmol-1��
4NH3(g)+3O2(g)�����Ǣ١�2-3���ڵõ�������Ӧ���ʱ䣩��H=��-92.4kJmol-1����2-3��-571.6kJmol-1��=1530kJmol-1��
��3��������Ӧ�������С�ķ��ȷ�Ӧ����ͼ��֪��t1���淴Ӧ���ʾ��������淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ�����¶ȣ�t3���淴Ӧ����ͬ�ȳ̶ȵ����ı�����ӦΪʹ�ô�����t4ʱ���淴Ӧ���ʾ���С�����淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ��Сѹǿ��
����ͼ��֪��t1ƽ�������ƶ���t3���ƶ���t4ƽ�������ƶ�����ʹ�����ĺ������٣���0��t1ʱ����У������İٷֺ������ѡA��
��4�� N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��ʼ(mol) a 4-a 0
ת��(mol) x 3x 2x
ƽ��(mol) a-x 4-a-3x 2x
����ͼ���֪���������������Ϊ![]() =
=![]() =����,��a=2ʱ�ñ�ֵΪ����0.5,��N2��H2�����ʵ�����Ϊ2mol,N2��H2��Ͷ�ϱ�Ϊ1:1��
=����,��a=2ʱ�ñ�ֵΪ����0.5,��N2��H2�����ʵ�����Ϊ2mol,N2��H2��Ͷ�ϱ�Ϊ1:1��
�� N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��ʼ(mol/L) 2 2 0
ת��(mol/L) y 3y 2y
ƽ��(mol/L) 2-y 2-3y 2y
H2���������Ϊ25%=![]() ��y=0.4������ƽ�ⳣ��Ϊ
��y=0.4������ƽ�ⳣ��Ϊ![]() =25/32
=25/32
���ں��º����£�N2��H2��NH3��Ͷ��Ϊ1.5mol��0.5mol��1mol���൱����2mol������2mol����������ƽ���ǵ�Ч�ģ����ƽ��ʱH2���������Ϊ25%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ����
A. 1��3��4�����ױ�B.
1��3��4�����ױ�B.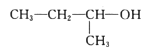 2������1������
2������1������
C.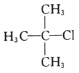 2������2���ȱ���D.
2������2���ȱ���D.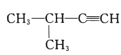 2������3����Ȳ
2������3����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��﮵������չ������ﮡ�����ﮡ���̼������������﮵ȵ����ϵ����ش��������⣺
��1����̬Niԭ�ӵļ۵����Ų�ʽΪ________����Niͬ�����һ�̬ԭ�Ӻ���ijɵ���������Ni��ͬ��Ԫ�ػ���__________�֡�
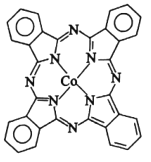
��2��̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ����������Ϊ�����ӣ������е�ԭ�ӵ��ӻ�����Ϊ___��
��3��Li�������ѳ�����﮵�ؽṹ̮������O2����ը��ʵ��֤ʵO2����е����Ӷ���Ϊ˳���Է��ӡ����нṹʽ���ڵ�������ӣ������п��ܴ���O2���ӽṹ����__������ĸ����
A ![]() B
B ![]() C
C ![]() D
D ![]()
��4����ͼΪSiO2������Siԭ����z�᷽����xyƽ���ͶӰͼ��������ͶӰͼ��������Oԭ����ȥ��Siԭ���Ա�ע�����ֱ�ʾÿ��Siԭ��λ��z��ĸ߶ȣ���SiA��SiB�ľ�����______��
��5��PCl5����ľ�����ͼ��ʾ���þ�������ʱ�γ�һ���ܵ����Һ�壬ʵ�������к���һ���������������Ӻ�һ���������������ӣ���P��Cl���ļ���ֻ��198pm��206pm���֣����õ��뷽��ʽ����PCl5�����ܵ����ԭ��____�������������������м��Ǵ���PCl3�ļ���ԭ��Ϊ_____����֪�þ���ľ����߳�Ϊapm��NAΪ����٤��������ֵ����þ�����ܶ�Ϊ__________g��cm��3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴ӦX(g)��2Y(g)![]() 3Z(g) ��H��0��һ���¶��£������Ϊ2 L���ܱ������м���4molY��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵������ȷ����
3Z(g) ��H��0��һ���¶��£������Ϊ2 L���ܱ������м���4molY��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵������ȷ����
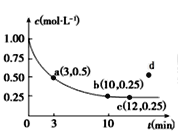
A.����������м���1molX��2molY����ƽ��ʱ��X��ƽ��Ũ�ȵ���0.125mol/L
B.a������Ӧ���ʴ����淴Ӧ����
C.��Ӧ��ƽ��ʱ�������¶Ȳ���ʵ��c��d��ת��
D.�������£���Ӧ��ƽ��ʱ��ƽ�ⳣ��K=3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(7��)ij����һ��˫������̬ϩ������һ��̬�����Ļ�����壬��ͬ��ͬѹ�����ܶ���H2��13��2�����ڱ�״���½�4��48L�������ͨ����������ˮ�������ˮ����3��36g����ԭ��������и�������������� (ע���������д�����̣����÷�)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�(CH3CH2OH)��һ����Ҫ���л���
(1)�����Ҵ�����ʽ�Ϳ��ܽṹ�Ʋ⣬1mol�Ҵ��������Ʒ�Ӧ���������������ʵ���������________________mol��
(2)ʵ��֤����Ӧ���Ҵ���������������ʵ�����ֵ��2���÷�Ӧ�Ļ�ѧ����ʽ��________________________________���Ҵ��Ĺ�������_______________��
(3)����ͼװ��ʵ�飬�����ձ����ڻ����ϣ�����ɫҺ�������
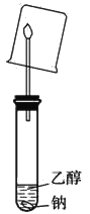
�ܷ�ݴ�˵��һ���������������жϼ�����������_________________________��
(4)�Ҵ����Ʒ�Ӧ��ˮ���Ʒ�Ӧƽ���Ķ࣬ԭ����_______________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ�Ϻ��������о�����������������(![]() )���뵼������������������ȵ���Ϻ��������о���Ա������(Se)����(Te)Ԫ�ع��ܵ�
)���뵼������������������ȵ���Ϻ��������о���Ա������(Se)����(Te)Ԫ�ع��ܵ�![]() ��Ƭ����1000�η��������絼�ʼ���δ�����仯���������ϵ�������Ӧ��Ӱ���С�����������Կɴ��������Ҫ�ش��������⣺
��Ƭ����1000�η��������絼�ʼ���δ�����仯���������ϵ�������Ӧ��Ӱ���С�����������Կɴ��������Ҫ�ش��������⣺
(1)Ag�ĺ�������Ų�ʽ��![]() ����Ag��Ԫ�����ڱ��е�λ����____�����й���
����Ag��Ԫ�����ڱ��е�λ����____�����й���![]() �ĵ����Ų�ʽ��д��ȷ����____(����)��
�ĵ����Ų�ʽ��д��ȷ����____(����)��
a��![]() b��
b��![]() c��
c��![]()
(2)����(![]() )��һ�ֺ����л���ʹ������ɷ������з�Ӧ��
)��һ�ֺ����л���ʹ������ɷ������з�Ӧ��![]()
������Sԭ�ӵ��ӻ�������______���������Ȼ�̼ԭ�ӵ��ӻ�������_____�������к��е�![]() ������
������![]() ����=_____��
����=_____��
(3)Cu��AgΪͬ��Ԫ�أ��۵㣺Cu________Ag(����>������<��)��ԭ����________________��
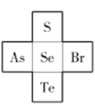
(4)S��Se��Te��Ԫ�����ڱ���������Ԫ�ص�λ�ù�ϵ����ͼ��ʾ����Te��As��Se��Br�ĵ�һ�������ɴ�С��˳��Ϊ________��![]() �Ŀռ乹��Ϊ________��
�Ŀռ乹��Ϊ________��
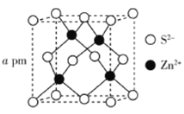
(5)ZnS�ľ����ṹ����ͼ��ʾ�����ܶ�Ϊ![]() �������߳�
�������߳�![]() ________pm(�ú�
________pm(�ú�![]() ��
��![]() �Ĵ���ʽ��ʾ��
�Ĵ���ʽ��ʾ��![]() Ϊ�����ӵ�������ֵ)��
Ϊ�����ӵ�������ֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ҽҩѧ��һ��ΰ��ı��⡣�Ŵ���ȡ����ҩ�������δ����������ԭ��Ӧ����( )
A | �����ݸ�Ŀ������ȡ����������( | ��â���ڷ���������ˮ�����Գ���Ʈ��Ҳ |
B | ��ͨ������������ȡ�����ǵ���(����Ǧ) | ��������ϣ������Ӵ�֮���þ�������ʢ�״�1������ǦƬ�����������ӿ����� |
C | ���������ܡ�����ȡ����ɰ��(��) | ˮ��һ��������������ȳ�����ɰͷ������ˮ��¯��֮���� |
D | ������ͼ��������ȡ����������(��������) | ����������Ƭ���ô����У������������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���ں����е�ѭ����������������̬ϵͳ�Ļ����ؼ���������������ѭ�����̿���ͼ��ʾ��
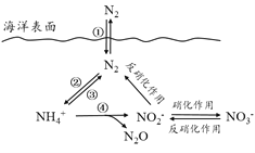
(1)�����еĵ�ѭ����ʼ�ڵ��Ĺ̶����������ڹ̵����õ�һ����__________(��ͼ���������)��
(2)���й��ں���ѭ����˵����ȷ����_______(����ĸ���)��
a.�����д�������̬�ĵ� b.�����еĵ�ѭ����ʼ�ڵ�������c.�����еķ���������һ���������IJ���d.�����ŷź�![]() �ķ�ˮ��Ӱ�캣����
�ķ�ˮ��Ӱ�캣����![]() �ĺ���
���
(3)����ʱ��������ϸ�������£�![]() ��ʵ�ֹ��̢ܵ�ת���������̢ܵ����ӷ���ʽ����������___
��ʵ�ֹ��̢ܵ�ת���������̢ܵ����ӷ���ʽ����������___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com