
【题目】中科院上海硅酸盐研究所开发出基于硫化银(![]() )柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的
)柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的![]() 薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
(1)Ag的核外电子排布式是![]() ,则Ag在元素周期表中的位置是____。下列关于
,则Ag在元素周期表中的位置是____。下列关于![]() 的电子排布式书写正确的是____(填标号)。
的电子排布式书写正确的是____(填标号)。
a.![]() b.
b.![]() c.
c.![]()
(2)乙硫醇(![]() )是一种含硫有机物,和醋酸银可发生下列反应:
)是一种含硫有机物,和醋酸银可发生下列反应:![]()
乙硫醇中S原子的杂化类型是______。乙酸中羧基碳原子的杂化类型是_____,乙酸中含有的![]() 键数:
键数:![]() 键数=_____。
键数=_____。
(3)Cu与Ag为同族元素,熔点:Cu________Ag(填“>”或“<”),原因是________________。
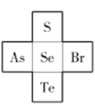
(4)S、Se、Te在元素周期表中与其他元素的位置关系如下图所示,则Te、As、Se、Br的第一电离能由大到小的顺序为________,![]() 的空间构型为________。
的空间构型为________。
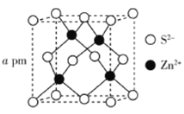
(5)ZnS的晶胞结构如下图所示,其密度为![]() ,晶胞边长
,晶胞边长![]() ________pm(用含
________pm(用含![]() 、
、![]() 的代数式表示,
的代数式表示,![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
【答案】第五周期IB族 b ![]()
![]() 7:1 > 铜和银的价电子数相同,Cu的原子半径比Ag的小,前者金属键强,熔点高
7:1 > 铜和银的价电子数相同,Cu的原子半径比Ag的小,前者金属键强,熔点高 ![]() 三角锥形
三角锥形 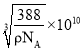
【解析】
根据原子的电子层数及其价电子数确定元素在周期表中的位置;根据原子及离子的电子排布式分析;根据价层电子对数目和价层电子互斥理论分析原子的杂化类型和空间构型;根据晶胞结构分析晶体的化学式并进行相关计算。
(1)Ag的核外电子排布式是![]() ,最高能层数是5,属ds区元素,则Ag在元素周期表中的位置是第五周期IB族;Ag原子失去5s1上的1个电子得到Ag+,则Ag+电子排布式书为
,最高能层数是5,属ds区元素,则Ag在元素周期表中的位置是第五周期IB族;Ag原子失去5s1上的1个电子得到Ag+,则Ag+电子排布式书为![]() ,故答案为b;
,故答案为b;
(2)乙硫醇(CH3CH2SH)中S原子的价层电子对数目为4,其中孤对电子数2,杂化类型是sp3杂化;羧基中碳原子的价层电子对数为3,无孤对电子,杂化类型是sp2杂化;乙酸的结构式为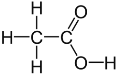 ,其中单键均为σ键,双键中有1个σ键和1个π键,则含有的σ键数:π键数=7:1;
,其中单键均为σ键,双键中有1个σ键和1个π键,则含有的σ键数:π键数=7:1;
(3)Cu与Ag为同族元素,铜和银的价电子数相同,且Ag的核电荷数大,Cu的原子半径比Ag的小,Cu金属键强,Cu熔点高,即熔点:Cu>Ag;
(4) As、Se、Br同周期随原子序数增大第一电离能呈增大趋势,但As元素原子4p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,Se、Te同主族,自上而下第一电离能减小,故第一电离能:Br>As>Se>Te;SeO32-中Se的价层电子对数目为3+![]() =4,其中孤对电子数目为1,VSEPR模型为四面体,忽略孤对电子可得微粒空间构型为三角锥形;
=4,其中孤对电子数目为1,VSEPR模型为四面体,忽略孤对电子可得微粒空间构型为三角锥形;
(5)ZnS的晶胞结构中含有Zn2+数目4,S2-数目为8×![]() +6×
+6×![]() =4,则晶胞质量为
=4,则晶胞质量为![]() g,晶胞的体积为(acm) 3,根据
g,晶胞的体积为(acm) 3,根据![]() 可知,a=
可知,a=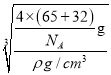 =
=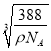 cm=
cm=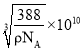 pm。
pm。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如下图所示。
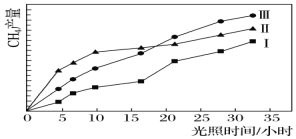
(1)在0~30小时内,CH4的平均生成速率vⅠ、vⅡ、vⅢ从大到小的顺序为__________;反应开始后的12小时内,在第________种催化剂作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ·mol-1。
①在下列坐标图中,画出反应过程中体系能量变化图(进行必要标注)。________;

②将等物质的量的CH4和H2O(g)充入1 L恒容密闭反应器,某温度下反应达平衡,平衡常数K=27,此时测得CO的物质的量为0.10 mol,则CH4的平衡转化率为________(结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1,写出由CO2生成CO的热化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
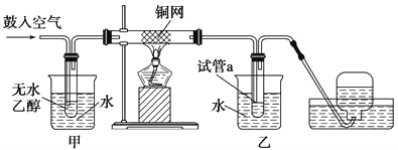
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式__________________ 、_____________________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是____________ 反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如图所示。
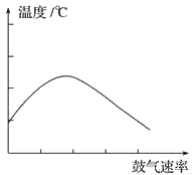
试解释出现图中现象的原因_______________________。
(3)甲和乙两个水浴作用不相同。甲的作用是_______________;乙的作用是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______。要除去该物质,可在混合液中加入________ (填写字母)。然后,再通过________________(填实验操作名称)即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1909年德国化学家哈伯在实验室首次合成氨,合成氨技术的创立开辟了人工固氮的重要途径,其研究正是基于科学化学反应原理的指导。
(1)已知298K时,N2(g)+3H2(g)![]() 2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
(2)目前处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1=﹣92.4kJ/mol
2NH3(g) ΔH1=﹣92.4kJ/mol
2H2(g)+ O2(g)![]() 2H2O(l) ΔH2=﹣571.6kJ/mol
2H2O(l) ΔH2=﹣571.6kJ/mol
2N2(g)+ 6H2O(l)![]() 4NH3(g)+3O2(g) ΔH3
4NH3(g)+3O2(g) ΔH3
则ΔH3=___kJ/mol。
(3)合成氨反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

①t4时刻,体系中是什么条件发生了变化?t4____。
②下列时间段中,氨的百分含量最高的是____。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
(4)在容积为1L的密闭装置中,充入4mol合成气(N2、H2),在400℃时反应,N2的体积分数随时间变化关系如图所示。
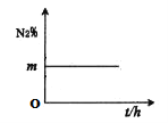
①N2、H2的投料比为____。
②反应达到平衡后,测得装置中H2的体积分数为25%,则400℃时,合成氨反应的平衡常数为___(可用分数表示)。
③在恒温恒容下,N2、H2、NH3的投料为1.5mol、0.5mol、1mol,平衡时H2的体积分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A. A、B的相对分子质量之差为60B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3D. B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的两种有机物都由碳、氢、氧三种元素组成,下列叙述不正确的是( )

A.①和②都含有官能团羟基B.①和②具有相似的化学性质
C.①和②为同系物D.①和②所含氧元素的质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如图:
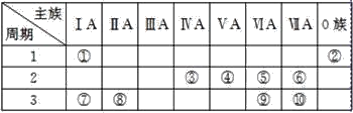
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是___(填写元素符号)。
(2)①和④号元素形成的化合物的化学式为___,用电子式表示其形成过程为___。
(3)⑧号元素的最高价氧化物的水化物的化学式是___。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是__,在该化合物中既含有___键,又含有____键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com