
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g),体系中n(NO2)随时间的变化如表:
2NO2(g),体系中n(NO2)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)(mol) | 0.00 | 0.010 | 0.012 | 0.013 | 0.013 | 0.013 |
(1)写出该反应的平衡常数表达式:K=____________。已知:K(350℃)300℃),则该反应是________(填吸或放)热反应。
(2)下图中表示NO的变化的曲线是_________(填字母)用O2表示从0~2 s内该反应的平均速率v=_________。
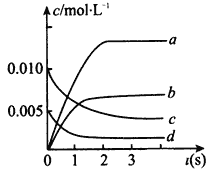
(3)能说明该反应已达到平衡状态的是______________(填字母)
A.c(NO2)=2c(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正(O2) D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有一包粉末状药品,可能由NaCl、 FeCl3 、 Al2(SO4)3中的一种或多种组成,某同学为确定其组成,进行如下实验(所加试剂均为过量)。请回答下列问题:
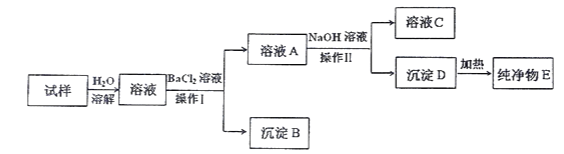
(1)操作Ⅰ的名称是___________。
(2)生产沉淀B的离子方程式为_________________________________。
(3)纯净物E是____________(填化学式,下同)。
(4)通过以上实验,确定该药品中一定含有______________,可能含有_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于安全事故的处理方法中,正确的是( )
A.皮肤上不慎沾上浓NaOH溶液,立即用稀硫酸冲洗
B.大量氯气泄漏时,应迅速离开现场,并尽快往高处去
C.不慎洒出的酒精在桌上着火时,立即用大量水扑灭
D.金属钠着火时,应立即用沾水的毛巾覆盖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是
A. 用药匙取用少量Na2SO4固体
B. 用胶头滴管滴加少量NaCl溶液
C. 用酒精灯直接加热试管、蒸发皿
D. 用10mL量筒量取8.50mL1.0 mol·L-1NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物M是生产玻璃钢的原料,其合成路线如下:
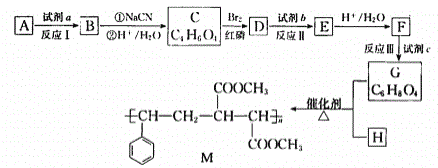
已知:![]()
(1)烃A的相对分子质量为28,其结构简式是________________。
(2)试剂a是________________。
(3)C的结构简式是________________。
(4)反应II的化学方程式是________________________。
(5)反应Ⅲ的反应类型是________________。
(6)G和H反应生成M的化学方程式是________________________。
(7)G的一种同分异构体N满足如下转化关系:
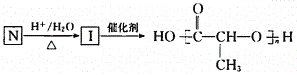
在该条件下,1 mol N生成2 mol I。N的结构简式是________________。
(8)已知: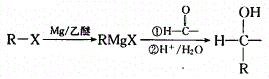
以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
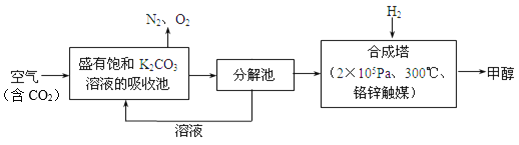
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_______________。
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
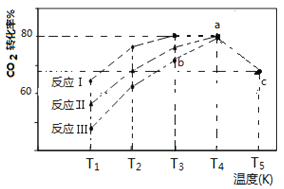
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。
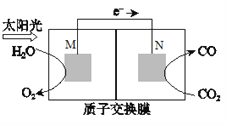
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 以铁作阳极,铂作阴极,电解饱和食盐水,可以制备烧碱
B. 25℃下,在NH3·H2O稀溶液中加水稀释,![]() 的值不变
的值不变
C. 工业生产硫酸时,接触室催化氧化S02时使用热交换器可以充分利用热量,降低生产成本
D. 反应![]() 室温下不能自发进行,则△H>0
室温下不能自发进行,则△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
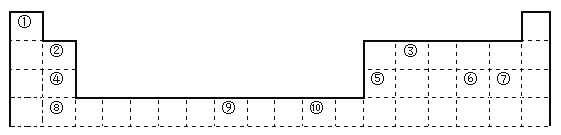
请回答下列问题:
(1)表中属于d区的元素是___________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_________。
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有______个,π键有______个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_______;该元素与元素①形成的分子X的空间构形为___________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com