
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
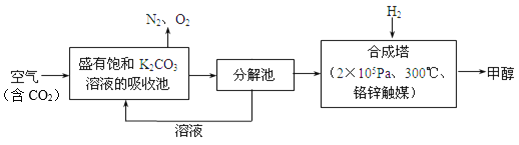
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_______________。
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
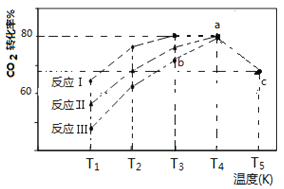
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
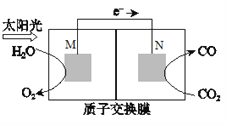
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。
【答案】 KHCO3(或碳酸氢钾) CO2(g)+ 3H2(g)![]() H2O(g)+ CH3OH(g) △H=== -53.7kJ/mol 减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用,低碳经济等。 反应I > 该反应为放热反应,温度升高,平衡逆向移动 K=16/3 (或K=3.70) CO2+2H++2e-===CO +H2O
H2O(g)+ CH3OH(g) △H=== -53.7kJ/mol 减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用,低碳经济等。 反应I > 该反应为放热反应,温度升高,平衡逆向移动 K=16/3 (或K=3.70) CO2+2H++2e-===CO +H2O
【解析】(1)把含有大量CO2的空气吹入K2CO3溶液中,碳酸钾与二氧化碳和水反应生成碳酸氢钾进入到分解池中,故分解池中的主要物质是碳酸氢钾;
(2)根据4400gCO2与足量H2反应,可放出5370 kJ的热量,则1molCO2与H2合成甲醇放出热量为53.70kJ,所以热化学方程式为CO2(g)+ 3H2(g)![]() H2O(g)+ CH3OH(g) △H=== -53.7kJ/mol;
H2O(g)+ CH3OH(g) △H=== -53.7kJ/mol;
(3)“绿色自由”构想流程中常包括物质的“循环利用”,上述流程中能体现“循环利用”的“绿色”有减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用,低碳经济等;
(4)①根据图中信息可知,在相同温度下,反应I的CO2的转化率最高,故其催化剂效果最佳;②a点时达到平衡,故b点时反应往正方向进行,v (正)>v (逆);③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是:该反应为放热反应,温度升高,平衡逆向移动,故a点的转化率比c点高;
④往2L恒容密闭容器中充入1 mol CO2和3 mol H2,
CO2(g)+ 3H2(g)![]() H2O(g)+ CH3OH(g)
H2O(g)+ CH3OH(g)
开始时的浓度/mol 0.5 1.5 0 0
改变的浓度/mol 0.5×![]() 1.5×
1.5×![]() 0.5×
0.5×![]() 0.5×
0.5×![]()
平衡时的浓度/mol 0.5×![]() 1.5×
1.5×![]() 0.5×
0.5×![]() 0.5×
0.5×![]()
K=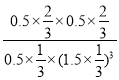 =
=![]() =3.70;
=3.70;
(5)根据图中信息可知,电子从M电极流向N电极,CO2得电子转化为CO,则N电极的电极反应式为:CO2+2H++2e-=CO +H2O。


科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气, KMnO4可用于吸收H2S),下列说法正确的是

A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与过氧化氢反应制备氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程涉及化学变化的是( )
A. 将I2溶于酒精制备碘酊
B. 将NaCl溶于水中制备生理盐水
C. 被果汁沾污的衣服浸入漂白液中清洗
D. 用激光笔照射鸡蛋清溶液产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
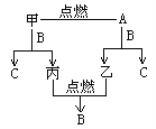
【题目】A、B、C是由H、O、Na三种元素中的两种或三种组成的化合物。甲、乙、丙是三种单质,分别由上述元素组成。上述单质和化合物之间存在如下反应关系:
完成下列空白:
(1)B的分子式____________。
(2)写出甲+B→C+丙的化学方程式_______________________________。
(3)用脱脂棉花包住约0.2g A的粉末,置于石棉网上,往脱脂棉花上滴水,可观察到脱脂棉花剧烈燃烧起来。
①由实验现象所得出的有关A和H2O反应的结论是___________(填代号)。
a.反应放热 b.棉花在空气中可以自燃
c.有O2生成 d.A在空气中可以自燃
②写出A和H2O反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种瑞香素的衍生物的结构简式如图,下列有关该有机物性质的说法正确的是

A. 能与FeCl3溶液发生显色反应
B. 1 mol该有机物最多可与3 mol H2加成
C. 1 mol该有机物最多可与含4 molNaOH溶液反应
D. 1 mol该有机物与足量NaHCO3溶液反应可放出3 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A有如图所示的转化关系(部分产物已略去),已知H能使溴的CCl4溶液褪色。
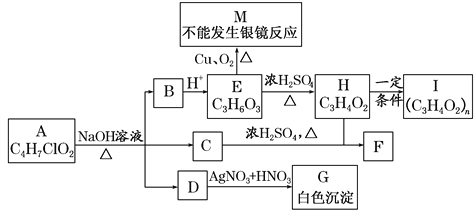
回答下列问题:
(1)A的结构简式为________。
(2)1 mol E与足量NaOH溶液反应时,消耗NaOH的物质的量为________mol。
(3)M的某些同分异构体能发生银镜反应,写出其中任意一种结构简式:________________。
(4)写出化学方程式H―→I:__________________________________。
(5)E通常可由丙烯、NaOH溶液、H2、O2、Br2等为原料合成,请按“A―→B―→C―→…”的形式写出反应流程,并在“―→”上注明反应类型但不需要注明试剂及反应条件________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化苄(C6H5CH2Cl)是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。
(1)写出甲苯与干燥氯气在光照条件下反应合成氯化苄的化学方程式________________。
(2)用下列方法分析氯化苄粗产品的纯度:
步骤I:称取2.555 g样品于烧瓶中,加入100.00 mL 4mol/L氢氧化钠溶液共热,冷却至室温。加入100.00 mL4mol/L硝酸,一段时间后,将烧瓶中的溶液全部转移至250.00 mL的容量瓶中,加水定容。
步骤II:从容量瓶中各取50.00 mL溶液于三只锥形瓶中,各加入25.00 mL0.2000mol/L硝酸银溶液。
步骤m:用硫酸铁铵作指示剂,用0.2000 mol/LNH4SCN溶液分别滴定剩余的硝酸银,所得滴定数据如下表。
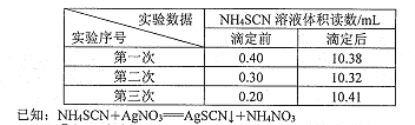
①加入硝酸的目的是____________。
②在步骤III操作中,判断达到滴定终点的现象是____。
③该样品中氯化苄的质量分数(写出计算过程)____。
④上述测定结果通常高于氯化苄中氯元素的理论含量,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的结构表示不正确的是
A.CH4的球棍模型示意图为:![]()
B.乙烯的实验式为:CH2
C.乙醇的结构简式:C2H5OH
D.2-乙基-1,3-丁二烯分子的键线式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com