
【题目】中国医药学是一个伟大的宝库。古代制取下列药物过程中未发生氧化还原反应的是( )
A | 《本草纲目》:制取“玄明粉”( | 以芒硝于风日中消尽水气,自成轻飘白粉也 |
B | 《通玄秘术》:制取“华盖丹”(醋酸铅) | 以铁筋穿作窍,以绳子穿之;用净瓷瓮子盛米醋1斗,将铅片子悬排于瓮子口…… |
C | 《本草蒙筌》:制取“灵砂”(硫化汞) | 水银一两,硫黄六铢,先炒作青砂头,后入水火炉抽之…… |
D | 《本草图经》:制取“铁华粉”(醋酸亚铁) | 以铁拍做段片,置醋糟中,积久衣生…… |
A.AB.BC.CD.D
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动从海水中提取金属锂的装置,示意图如图所示。该装置工作时,下列说法正确的是
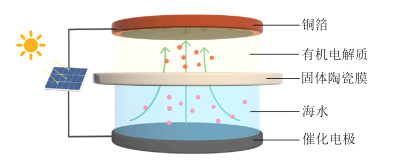
A.铜箔上的电势比催化电极上的高
B.海水的pH变大
C.若转移1mol电子,理论上铜箔增重7g
D.固体陶瓷膜可用质子交换膜代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1909年德国化学家哈伯在实验室首次合成氨,合成氨技术的创立开辟了人工固氮的重要途径,其研究正是基于科学化学反应原理的指导。
(1)已知298K时,N2(g)+3H2(g)![]() 2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___(填“能”或“不能”)自发进行。
(2)目前处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1=﹣92.4kJ/mol
2NH3(g) ΔH1=﹣92.4kJ/mol
2H2(g)+ O2(g)![]() 2H2O(l) ΔH2=﹣571.6kJ/mol
2H2O(l) ΔH2=﹣571.6kJ/mol
2N2(g)+ 6H2O(l)![]() 4NH3(g)+3O2(g) ΔH3
4NH3(g)+3O2(g) ΔH3
则ΔH3=___kJ/mol。
(3)合成氨反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

①t4时刻,体系中是什么条件发生了变化?t4____。
②下列时间段中,氨的百分含量最高的是____。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
(4)在容积为1L的密闭装置中,充入4mol合成气(N2、H2),在400℃时反应,N2的体积分数随时间变化关系如图所示。
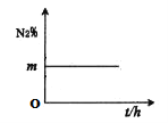
①N2、H2的投料比为____。
②反应达到平衡后,测得装置中H2的体积分数为25%,则400℃时,合成氨反应的平衡常数为___(可用分数表示)。
③在恒温恒容下,N2、H2、NH3的投料为1.5mol、0.5mol、1mol,平衡时H2的体积分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A. A、B的相对分子质量之差为60B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3D. B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的两种有机物都由碳、氢、氧三种元素组成,下列叙述不正确的是( )

A.①和②都含有官能团羟基B.①和②具有相似的化学性质
C.①和②为同系物D.①和②所含氧元素的质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100ml pH=1的硫酸溶液中,加入多少毫升0.01mol·L-1的NaOH溶液,才能使混合液的pH=2?(假设溶液体积不变)______________ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如下表:

(1)写出元素T的原子结构示意图___。
(2)元素Y与元素Z相比,金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填序号)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质剧烈
D.Y最高价氧化物的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,写出该化合物的化学式___,该化合物与二氧化碳反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com