
【题目】在100ml pH=1的硫酸溶液中,加入多少毫升0.01mol·L-1的NaOH溶液,才能使混合液的pH=2?(假设溶液体积不变)______________ mL
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)![]() 3Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4molY和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法不正确的是
3Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4molY和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法不正确的是
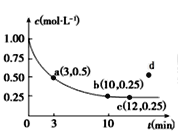
A.若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度等于0.125mol/L
B.a点正反应速率大于逆反应速率
C.反应达平衡时,降低温度不能实现c到d的转化
D.该条件下,反应达平衡时,平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国医药学是一个伟大的宝库。古代制取下列药物过程中未发生氧化还原反应的是( )
A | 《本草纲目》:制取“玄明粉”( | 以芒硝于风日中消尽水气,自成轻飘白粉也 |
B | 《通玄秘术》:制取“华盖丹”(醋酸铅) | 以铁筋穿作窍,以绳子穿之;用净瓷瓮子盛米醋1斗,将铅片子悬排于瓮子口…… |
C | 《本草蒙筌》:制取“灵砂”(硫化汞) | 水银一两,硫黄六铢,先炒作青砂头,后入水火炉抽之…… |
D | 《本草图经》:制取“铁华粉”(醋酸亚铁) | 以铁拍做段片,置醋糟中,积久衣生…… |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)![]() 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是______%(保留整数)。
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应__________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 _______。将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ________(填字母序号)。
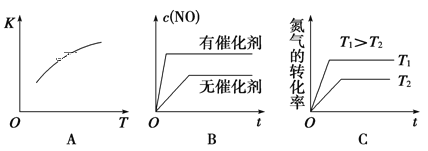
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大、“变小”或“不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):
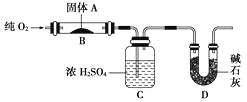
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
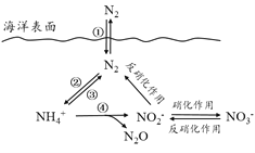
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用![]() 处理
处理![]() 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用![]() 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
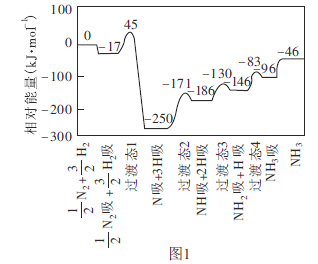
①该反应历程中正反应的最大活化能为________![]() 。
。
②合成氨反应的热化学方程式为_________________。
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中![]() 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的![]() ________N点的
________N点的![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
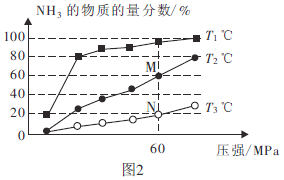
②![]() ℃时,将
℃时,将![]()
![]() 和
和![]()
![]() 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________![]() (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
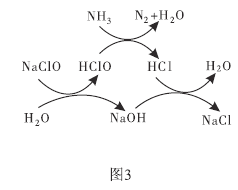
(3)①用次氯酸钠除去氨氮(以![]() 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。
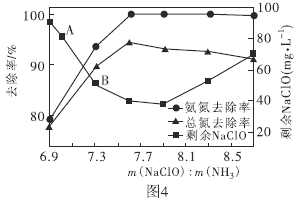
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随![]() 的变化情况如图4所示。当
的变化情况如图4所示。当![]() 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将![]() 转化为
转化为![]() ,部分装置如图5所示。
,部分装置如图5所示。
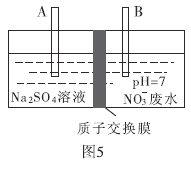
①B电极的电极反应式是________.
②常温下,除去10L废水中的![]()
![]() 后,最终废水的
后,最终废水的![]() ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推是一种重要的学习方法,下列说法不正确的是
A. 已知分子式为C5H12O的醇有8种,则分子式为C6H12O2的羧酸也有8种
B. 已知分子式为C7H14O的酮有15种,则分子式为C7H14O2的酯也有15种
C. 已知丙烷的一氯一溴代物有5种,则分子式为C4H9NO2的氨基酸也有5种
D. 已知金刚烷( )的二氯代物有6种,则金刚烷的十四氯代物也有6种
)的二氯代物有6种,则金刚烷的十四氯代物也有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com