
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)![]() 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是______%(保留整数)。
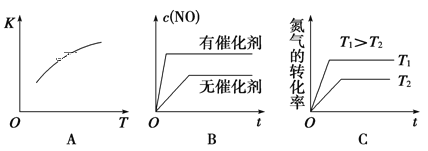
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应__________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 _______。将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ________(填字母序号)。
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大、“变小”或“不变)
【答案】4 向正反应方向进行 Qc=9×10﹣4<K AC 不变
【解析】
(1)根据反应方程式,利用三段式法结合平衡常数计算转化率;
(2)计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论,根据温度、催化剂对反应速率和平衡移动的影响判断;
(3)根据化学方程式的特点结合压强对平衡的影响分析。
(1)设平衡时氮气的转化的物质的量为x,则根据反应方程式N2(g)+O2(g)![]() 2NO(g)可知,反应会消耗O2的物质的量是x mol,同时产生2x mol NO,则平衡时各种气体的物质的量n(N2)=n(O2)=(1-x)mol,n(NO)=2x mol,由于该反应是反应前后等体积的反应,所以化学平衡常数中可以用相应的物质的量代替物质的量浓度,可得
2NO(g)可知,反应会消耗O2的物质的量是x mol,同时产生2x mol NO,则平衡时各种气体的物质的量n(N2)=n(O2)=(1-x)mol,n(NO)=2x mol,由于该反应是反应前后等体积的反应,所以化学平衡常数中可以用相应的物质的量代替物质的量浓度,可得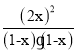 =64×10-4,解得x=0.04mol,所以平衡时N2的转化率为
=64×10-4,解得x=0.04mol,所以平衡时N2的转化率为![]() × 100%=4%;
× 100%=4%;
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为: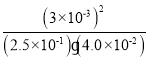 =9×10-4<K,说明反应未达到化学平衡,反应向正反应方向进行;
=9×10-4<K,说明反应未达到化学平衡,反应向正反应方向进行;
A.该反应的正反应为吸热反应,升高温度,化学平衡向正反应进行,平衡常数增大,A正确;
B.加入催化剂,反应速率增大,但由于正、你反应速率增大的倍数相同,所以化学平衡不发生移动,B错误;
C.升高温度,反应速率增大,达到平衡所需要的时间缩短,且升高温度,化学平衡向吸热的正反应方向移动,使氮气的平衡转化率增大,C正确;
故合理选项是AC;
(3)由于该反应是反应前后气体体积不变的反应,所以增大压强对平衡移动没有影响。只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时的平衡混合气中NO的体积分数不变。


科目:高中化学 来源: 题型:
【题目】实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
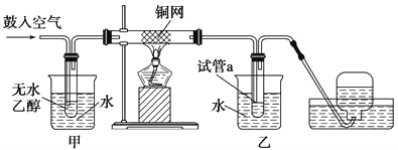
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式__________________ 、_____________________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是____________ 反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如图所示。
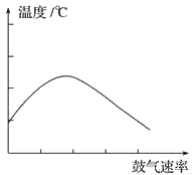
试解释出现图中现象的原因_______________________。
(3)甲和乙两个水浴作用不相同。甲的作用是_______________;乙的作用是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______。要除去该物质,可在混合液中加入________ (填写字母)。然后,再通过________________(填实验操作名称)即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A. A、B的相对分子质量之差为60B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3D. B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的两种有机物都由碳、氢、氧三种元素组成,下列叙述不正确的是( )

A.①和②都含有官能团羟基B.①和②具有相似的化学性质
C.①和②为同系物D.①和②所含氧元素的质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol H2完全燃烧生成水蒸气放出热量242kJ,且H2中1mol H-H键断裂时吸收热量436kJ,水蒸气中形成1mol H-O键时放出热量463 kJ,则O2中1mol O=O键断裂时吸收的热量为
A.556 kJB.496 kJC.336 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100ml pH=1的硫酸溶液中,加入多少毫升0.01mol·L-1的NaOH溶液,才能使混合液的pH=2?(假设溶液体积不变)______________ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如图:
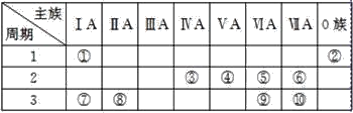
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是___(填写元素符号)。
(2)①和④号元素形成的化合物的化学式为___,用电子式表示其形成过程为___。
(3)⑧号元素的最高价氧化物的水化物的化学式是___。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是__,在该化合物中既含有___键,又含有____键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
![]()
(1)A的化学式是__________,B的化学式是________,C的化学式是__________。
(2)加入过量A的目的是__________________。
(3)加入过量B的目的是____________________。
(4)加热煮沸的目的是________________________。
(5)操作Ⅰ的名称是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com