
【题目】现有部分元素的性质与原子(或分子)结构如下表:

(1)写出元素T的原子结构示意图___。
(2)元素Y与元素Z相比,金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填序号)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质剧烈
D.Y最高价氧化物的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,写出该化合物的化学式___,该化合物与二氧化碳反应的化学方程式为___。
【答案】![]() Na CD Na2O2 2Na2O2+2CO2=2Na2CO3+O2
Na CD Na2O2 2Na2O2+2CO2=2Na2CO3+O2
【解析】
由表中信息可知:T为氧元素,X为氮元素,Y为钠元素,Z为铝元素,据此回答。
由表中信息可知:T为氧元素,X为氮元素,Y为钠元素,Z为铝元素。
(1)写出元素T的原子结构示意图![]() ,故答案为:
,故答案为:![]() ;
;
(2)Na比Al金属性强;
A.Y单质的熔点比Z单质低,熔点与金属性无关,故A错误;
B.Y的化合价比Z低,化合价高低与金属性无关,故B错误;
C.Y单质与水反应比Z单质剧烈,则Y金属性比Z强,故C正确;
D.Y最高价氧化物的水化物的碱性比Z的强,则Y金属性比Z强,故D正确;
故答案为:Na;CD;
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物为Na2O2该化合物与二氧化碳反应的化学方程式为![]() ,故答案为:Na2O2;
,故答案为:Na2O2;![]() 。
。


科目:高中化学 来源: 题型:
【题目】中国医药学是一个伟大的宝库。古代制取下列药物过程中未发生氧化还原反应的是( )
A | 《本草纲目》:制取“玄明粉”( | 以芒硝于风日中消尽水气,自成轻飘白粉也 |
B | 《通玄秘术》:制取“华盖丹”(醋酸铅) | 以铁筋穿作窍,以绳子穿之;用净瓷瓮子盛米醋1斗,将铅片子悬排于瓮子口…… |
C | 《本草蒙筌》:制取“灵砂”(硫化汞) | 水银一两,硫黄六铢,先炒作青砂头,后入水火炉抽之…… |
D | 《本草图经》:制取“铁华粉”(醋酸亚铁) | 以铁拍做段片,置醋糟中,积久衣生…… |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
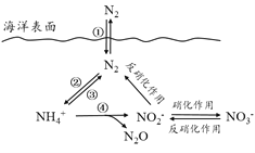
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用![]() 处理
处理![]() 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用![]() 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
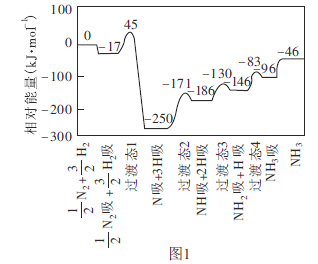
①该反应历程中正反应的最大活化能为________![]() 。
。
②合成氨反应的热化学方程式为_________________。
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中![]() 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的![]() ________N点的
________N点的![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
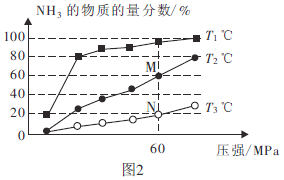
②![]() ℃时,将
℃时,将![]()
![]() 和
和![]()
![]() 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________![]() (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
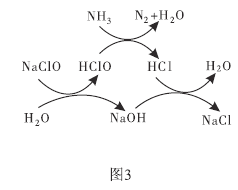
(3)①用次氯酸钠除去氨氮(以![]() 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。
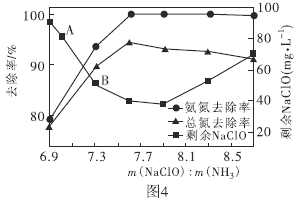
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随![]() 的变化情况如图4所示。当
的变化情况如图4所示。当![]() 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将![]() 转化为
转化为![]() ,部分装置如图5所示。
,部分装置如图5所示。
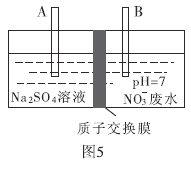
①B电极的电极反应式是________.
②常温下,除去10L废水中的![]()
![]() 后,最终废水的
后,最终废水的![]() ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取Cl2的反应:
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
A.氧化剂是MnO2,还原剂是HCl
B.每生成1 mol Cl2,转移电子的物质的量是2 mol
C.每消耗1 mol MnO2,表现还原作用的HCl为4 mol
D.Cl2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推是一种重要的学习方法,下列说法不正确的是
A. 已知分子式为C5H12O的醇有8种,则分子式为C6H12O2的羧酸也有8种
B. 已知分子式为C7H14O的酮有15种,则分子式为C7H14O2的酯也有15种
C. 已知丙烷的一氯一溴代物有5种,则分子式为C4H9NO2的氨基酸也有5种
D. 已知金刚烷( )的二氯代物有6种,则金刚烷的十四氯代物也有6种
)的二氯代物有6种,则金刚烷的十四氯代物也有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com