
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法正确的是( )
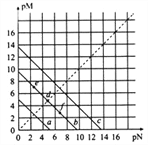
A. a线代表的是PbCO3
B. T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=3×10-5
C. d点可以代表CaCO3的饱和溶液,且c(Ca2+)= c(CO32-)
D. T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)③和⑧的最高价含氧酸的酸性强弱关系是_____________________________(用化学式填写)。
(2)⑥、⑦、⑩的简单离子的离子半径由大到小的顺序是________________(用离子符号表示)。
(3)由⑨与⑩形成的某种分子中各原子都满足最外层为8电子结构,其化学式是_________;由⑤与⑥形成的某种化合物中含有两类化学键,该化合物的电子式为___________。
(4)⑦的最高价氧化物对应水化物与⑥的最高价氧化物对应水化物反应的离子方程式为:________。
(5)⑧与⑩相比,非金属性较强的是_______(用元素符号表示),下列事实能证明这一结论的是_______(填字母序号)
a. 常温下⑧的单质呈固态,⑩的单质呈气态
b. ①与⑧和⑩形成的化合物分别为X和Y,稳定性Y>X
c. ⑧与⑩形成的化合物中⑧呈正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种一元酸HA、HB、HC的钠盐分别为NaA、NaB、NaC,它们的物质的量浓度相同时,溶液的PH依次为9,10,8.则这三种弱酸的酸性由强到弱的顺序是( )
A. HA>HB>HC B. HB>HA>HC C. HC>HB>HA D. HC>HA>HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金性质的说法中,错误的是( )
A. 合金的硬度一般比其各成分金属的硬度高
B. 合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的的物理性质不同
D. 合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为___________。
(2)“溶解”时放出的气体为________(填化学式)。硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。如图表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是________________。

(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为。
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH1”时,溶液pH范围为________;过滤2所得滤渣的成分________(填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式________________。
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液。它的充、放电反应为:xNi(OH)2+M![]() MHx+xNiOOH;电池充电过程中阳极的电极反应式为________;放电时负极的电极反应式为________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为________;放电时负极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大。E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态。请回答下列问题:
(1)Y原子基态核外电子排布式为__________;基态Z原子中电子占据的最高能层符号为_________。
(2)F、D、X的电负性由小到大的顺序为__________(用元素符号表示)。
(3)E、F、D、X形成的有机物FX(DE2)2中F的杂化轨道类型为____________,DX3-离子的立体构型是___________。
(4)下列关于F2E2分子和E2X2分子的说法正确的是________。
a.分子中都含σ键和π键 b.F2E2分子的沸点明显低于E2X2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体
(5)将Z单质的粉末加入到DE3的浓溶液中,并通入X2,充分反应后溶液呈深蓝色,该反应的离子方程式为________。
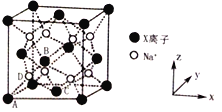
(6)X和Na的一种离子化合物的晶胞结构如图,该离子化合物为_________(填化学式)。Na+的配位数为_________。晶胞有两种基本要素,一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() ),C为(
),C为(![]() ,
, ![]() ,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中
A. 一定有SO42- B. 可能有SO42- 或Ag+ C. 一定无Ag+ D. 还可能有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是:①地壳中的金属元素的含量②金属活动性③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A. ①③ B. ②⑤ C. ③⑤ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com