
【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)③和⑧的最高价含氧酸的酸性强弱关系是_____________________________(用化学式填写)。
(2)⑥、⑦、⑩的简单离子的离子半径由大到小的顺序是________________(用离子符号表示)。
(3)由⑨与⑩形成的某种分子中各原子都满足最外层为8电子结构,其化学式是_________;由⑤与⑥形成的某种化合物中含有两类化学键,该化合物的电子式为___________。
(4)⑦的最高价氧化物对应水化物与⑥的最高价氧化物对应水化物反应的离子方程式为:________。
(5)⑧与⑩相比,非金属性较强的是_______(用元素符号表示),下列事实能证明这一结论的是_______(填字母序号)
a. 常温下⑧的单质呈固态,⑩的单质呈气态
b. ①与⑧和⑩形成的化合物分别为X和Y,稳定性Y>X
c. ⑧与⑩形成的化合物中⑧呈正价
【答案】 H2CO3>H2SiO3 Cl->Na+>Al3+ PCl3 ![]() OH-+Al(OH)3=AlO2-+2H2O Cl bc
OH-+Al(OH)3=AlO2-+2H2O Cl bc
【解析】根据元素①~⑩在表中的位置可判断它们分别是H、B、C、N、O、Na、Al、Si、P、Cl。则
(1)同主族从上到下非金属性逐渐减弱,最高价含氧酸的酸性逐渐减弱,因此③和⑧的最高价含氧酸的酸性强弱关系是H2CO3>H2SiO3。(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则⑥、⑦、⑩的简单离子的离子半径由大到小的顺序是Cl->Na+>Al3+。(3)由P与Cl形成的某种分子中各原子都满足最外层为8电子结构,该物质是三氯化磷,其化学式是PCl3;由O与Na形成的某种化合物中含有两类化学键,该化合物是过氧化钠,电子式为![]() 。(4)⑦的最高价氧化物对应水化物氢氧化铝是两性氢氧化物,与⑥的最高价氧化物对应水化物氢氧化钠反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O。(5)同周期自左向右非金属性逐渐正确,⑧与⑩相比,非金属性较强的是Cl。a. 非金属性强弱与单质的状态没有关系,a错误;b. 非金属性越强,氢化物越稳定,b正确;c. ⑧与⑩形成的化合物中⑧呈正价说明共用电子对偏向氯原子,可以说明非金属性氯元素强于磷,c正确,答案选bc。
。(4)⑦的最高价氧化物对应水化物氢氧化铝是两性氢氧化物,与⑥的最高价氧化物对应水化物氢氧化钠反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O。(5)同周期自左向右非金属性逐渐正确,⑧与⑩相比,非金属性较强的是Cl。a. 非金属性强弱与单质的状态没有关系,a错误;b. 非金属性越强,氢化物越稳定,b正确;c. ⑧与⑩形成的化合物中⑧呈正价说明共用电子对偏向氯原子,可以说明非金属性氯元素强于磷,c正确,答案选bc。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. NaHCO3=Na++HCO3- B. KClO3=K++Cl-+3O2-
C. Ca(NO3)2=Ca2++2(NO3)2- D. 熔融状态下:NaHSO4=Na++H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 利用丁达尔效应可以区分溶液和胶体
B. 所有金属元素都可以用焰色反应来鉴别
C. 水泥、玻璃、光导纤维的主要成分都属于硅酸盐
D. pH值小于7的雨水称为酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行探究:
Ⅰ. 鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有_____________溶液的试管。
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是__________(用离子方程式解释)。
Ⅱ. 如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

(1)装置B中试剂X是_______,装置D中盛放NaOH溶液的作用是_______________________。
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_____________________________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为______________;发生反应的离子方程式是_____________________。
Ⅲ. 用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入右图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

(1)M极发生的电极反应式为____________________________。
(2)若使该装置的电流强度达到2.0 A,理论上每分钟应向负极通入标准状况下气体的体积为_____L(已知:1个e所带电量为1.6×10-19C)。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是 ( )
A. 反应达平衡时,X的转化率为50%
B. 反应可表示为:X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CH3Cl、CH2Cl2、CHCl3、CCl4互为同系物
B.O2和O3互为同素异形体
C.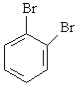 和
和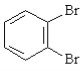 互为同分异构体
互为同分异构体
D.1H、2H、3H、H2互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A在周期表中的位置是____________________, D的离子结构示意图____________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是________________。(用离子符号回答)
(3)写出B在空气中燃烧产物的电子式_________,该产物所含有的化学键类型有___________。
(4)在实验室里,D的单质常用B的最高价氧化物的水化物溶液来吸收,写出该反应的离子方程式_______________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法正确的是( )
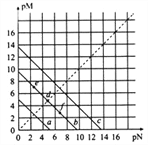
A. a线代表的是PbCO3
B. T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=3×10-5
C. d点可以代表CaCO3的饱和溶液,且c(Ca2+)= c(CO32-)
D. T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是 ( )
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔是物质的量的单位,简称摩,符号为mol
C. 摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D. 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com