
 H2S��һ����ɫ���ж��Ŀ�ȼ�����壬��ˮ��Һ�������ᣨ��Ԫ���ᣩ��
H2S��һ����ɫ���ж��Ŀ�ȼ�����壬��ˮ��Һ�������ᣨ��Ԫ���ᣩ��
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
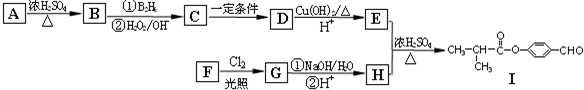
 R-CH2CH2OH��
R-CH2CH2OH���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
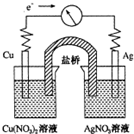 ����ӦCu��s��+2Ag+��aq���TCu2+��aq��+2Ag��s����Ƴ���ͼ��ʾ��ԭ��أ�����������ȷ���ǣ�������
����ӦCu��s��+2Ag+��aq���TCu2+��aq��+2Ag��s����Ƴ���ͼ��ʾ��ԭ��أ�����������ȷ���ǣ�������| A��KNO3�����е�K+����Cu��NO3��2��Һ |
| B��Ag��������Cu������ |
| C������һ��ʱ���Cu��NO3��2��Һ��c��Cu2+������ |
| D��ȡ�����ź����Ƶ�ָ����Ȼ����ƫת |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��40mL | B��30mL |
| C��20mL | D��10mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
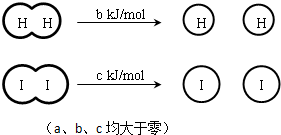
| A��H2��I2��HI�����еĻ�ѧ�����ǷǼ��Թ��ۼ� |
| B���Ͽ�2 mol HI�����еĻ�ѧ����������ԼΪ��c+b+a�� kJ |
| C����ͬ�����£�1 mol H2��g����1mol I2��g��������С��2 mol HI ��g���������� |
| D�����ܱ������м���2 mol H2��g����2 mol I2��g������ַ�Ӧ��ų�������Ϊ2a kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com