
| A、40mL | B、30mL |
| C、20mL | D、10mL |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
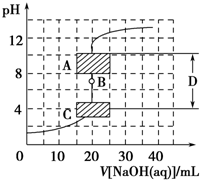 滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.查看答案和解析>>
科目:高中化学 来源: 题型:
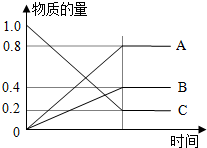 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、NO3-、H+ |
| B、Ba2+、Na+、Cl-、SO42- |
| C、Mg2+、H+、SO42-、OH- |
| D、H+、Na+、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
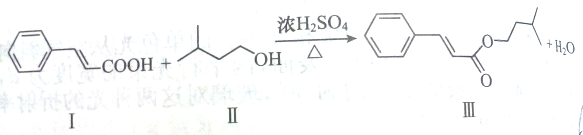
| A、Ⅱ物质的名称为2-甲基-4-丁醇 |
| B、Ⅲ物质的分子式为C14H18O2 |
| C、Ⅰ物质的9个碳原子一定共面 |
| D、Ⅲ物质中有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 (s) |
| B、(NH4)2SO4 (s) |
| C、K2SO4 (aq) |
| D、H2O (l) |
| E、CH3COONa(s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com