
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)①该反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速为 。
(2)说明该反应已达到平衡状态: 。
A.CO或(CO2)的生成速率与消耗速率相等
B.CO(或CO2)的质量不再改变
C.CO(或CO2)的体积分数50%
(3)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
I2(s)+5O2(g)=2I2O5(s) △H1=-75.56kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:
【答案】(1)![]() (1分)
(1分)![]() (2分)(2)ab(1分)
(2分)(2)ab(1分)
(3)5CO(g)+I2O5(s)=5CO2(g)+I2(s)△H=-1377.22kJ·mol-1(3分)
【解析】
试题分析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的平衡常数表达式K=![]() 。
。
②11.2g铁是11.2g÷56g/mol=0.2mol,根据方程式可知消耗CO是0.3mol,浓度是0.15mol/L,所以10min内CO的平均反应速为0.15mol/L÷10min=0.015mol/(L·min)。
(2)A.CO或(CO2)的生成速率与消耗速率相等,说明反应达到平衡状态,a正确;B.CO(或CO2)的质量不再改变说明反应达到平衡状态,b正确;C.CO(或CO2)的体积分数50%时正逆反应速率不一定相等,反应不一定达到平衡状态,c错误,答案选ab。
(3)已知:①2I2(s)+5O2(g)=2I2O5(s) △H1=-75.56kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
根据盖斯定律可知(②×5-①)÷2即得到CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式为5CO(g) + I2O5(s)=5CO2(g) + I2(s) △H=-1377.22kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列离子方程式中,能正确反映CH3COOH 与 NaOH反应的是( )
A. CH3COOH+OH﹣═CH3COO﹣+H2O B. H++OH﹣=H2O
C. CH3COOH+Na++OH﹣═CH3COONa+H2O D. CH3COO﹣+H++OH﹣═CH3COO﹣+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是

A.原混合酸中NO3-物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂除去下列物质中的少量杂质,正确的是 ( )
A. 溴苯中的溴(KI溶液) B. 甲烷中的乙烯(溴水)
C. 乙酸乙酯中的乙酸(乙醇) D. 二氧化碳中的氯化氢(KOH溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
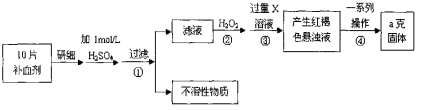
请回答下列问题:
(1) 步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有 (填离子符号),检验滤液中还存在Fe2+的方法为 (注明试剂、现象)。
(2) 步骤②加入过量H2O2的目的是 。
(3) 步骤③中反应的离子方程式为 。
(4) 步骤④中一系列处理的操作步骤包括:过滤、 、灼烧、 、称量。
(5) 若实验无损耗,则每片补血剂含铁元素的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
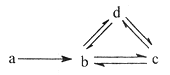
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | N2 | NO | NO2 | HNO3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Na | NaOH | Na2CO3 | NaHCO3 |
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是( )
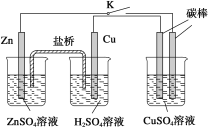
A.铜棒为正极,其电极反应式为2H++2e-→H2↑
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.反应中消耗锌的质量为13 g
D.导线中通过的电子的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
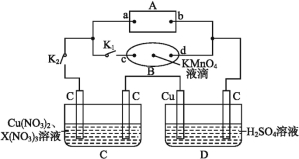
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电一段时间后,滤纸d端的电极反应式是 。
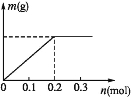
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1 mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com