
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
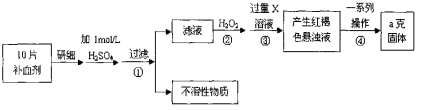
请回答下列问题:
(1) 步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有 (填离子符号),检验滤液中还存在Fe2+的方法为 (注明试剂、现象)。
(2) 步骤②加入过量H2O2的目的是 。
(3) 步骤③中反应的离子方程式为 。
(4) 步骤④中一系列处理的操作步骤包括:过滤、 、灼烧、 、称量。
(5) 若实验无损耗,则每片补血剂含铁元素的质量为 g。
【答案】(1)Fe3+ 取一定量滤液,滴加少量KMnO4溶液,KMnO4溶液退色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH- = Fe(OH)3↓(或Fe3++3NH3·H2O = Fe(OH)3+3NH4+)
(4)洗涤 冷却
(5)0.07a(或![]() 及其化简形式,如
及其化简形式,如![]() )
)
【解析】
试题分析:1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在;Fe2+具有还原性,可以被氧化剂氧化,滴加少量KMnO4溶液,KMnO4溶液退色,将Fe2+氧化为Fe3+,证明含有Fe2+(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+.(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;(FeSO4·7H2O) ag Fe2O3 的物质的量为a/160mol, n(Fe)=2×a/160mol= a/80 mol,m(Fe)=56×a/80 =0.7 a g,10片补血剂含铁元素质量0.7 a,每片补血剂含铁元素的质量为0.07 a g;


科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
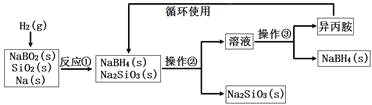
下列说法不正确的是
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如下图所示。

(1)为提高锌灰的浸取率,可采用的方法是____________(填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是_______________(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________ 。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是______________,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取。化学反应方式为_________________;

③已知Na2SO4.10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4.10H2O的操作方法是________________________.
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A. 该反应可表示为X(g) + 2Y(g)![]() 2Z(g) + 2W(g)
2Z(g) + 2W(g)
B. 减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C. 增大反应容器的压强,该反应速率一定增大
D. 升高温度,W(g)体积分数增加,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)①该反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速为 。
(2)说明该反应已达到平衡状态: 。
A.CO或(CO2)的生成速率与消耗速率相等
B.CO(或CO2)的质量不再改变
C.CO(或CO2)的体积分数50%
(3)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
I2(s)+5O2(g)=2I2O5(s) △H1=-75.56kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以乙苯催化脱氢制取苯乙烯的反应如下:
![]() (g)
(g)![]() (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定。在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示。

已知:气体分压(p分)= 气体总压(p总)×体积分数。不考虑副反应,下列说法正确的是
A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低
B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() × p总
× p总
D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是 ( )
A. 锌作阳极,铁制品作阴极,溶液中含Fe2+
B. 锌作阴极,铁制品作阳极,溶液中含Zn2+
C. 锌作阴极,铁制品作阳极,溶液中含Fe3+
D. 锌作阳极,铁制品作阴极,溶液中含Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是( )
A. I2 B. CO2 C. BaCO3 D. C6H12O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于工业固氮的是
A. N2与O2反应生成NO B. 由NH3转变成 NH4HCO3
C. N2与H2在一定条件下反应生成NH3 D. 豆科植物的根瘤吸收氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com