
【题目】短周期元素A、B、C、D、E、F,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题:
(1)写出B、C、E元素的名称B___、C___、E___。
(2)请写出含C质量分数最高的化合物的化学式:______ 。
(3)A、C、D、F四种元素可以形成两种可以互相反应的酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为______、______。
(4)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为________________________。
(5)向含有a molE离子的氯化物溶液中加入含b molD的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为_______________________________ 。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0⑥(4a-b)mol
【答案】氮 氧 铝 H2O2 NaHSO3 NaHSO4 HS-+OH-=S2-+H2O ②
【解析】
A、B、C、D、E、F是短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,则A为H元素;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X,则B为N元素,X为NH4NO3;D与A同主族,且D的原子序数大于N元素,故D为Na元素;F元素的最外层电子数是其次外层电子数的![]() 倍,F原子有3个电子层,最外层电子数为6,故F为S元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为O元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,是氢氧化铝与强碱、强酸反应,可推知E为Al元素,据此分析解答。
倍,F原子有3个电子层,最外层电子数为6,故F为S元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为O元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,是氢氧化铝与强碱、强酸反应,可推知E为Al元素,据此分析解答。
根据上述分析,A为H元素,B为N元素,C为O元素,D为Na元素,E为Al元素,F为S元素。
(1)由上述分析可知,B、C、E元素的名称分别为:氮、氧、铝,故答案为:氮;氧;铝;
(2) C为O元素,含O质量分数最高的化合物为过氧化氢,化学式为H2O2,故答案为:H2O2;
(3)H、O、N、S四种元素可以形成两种可以互相反应的酸式盐(均由四种元素组成)分别为NaHSO3、NaHSO4,故答案为:NaHSO3;NaHSO4;
(4)H、O、S间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,则甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,故答案为:HS-+OH-=S2-+H2O;
(5)向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,可能发生的反应有①AlCl3+3NaOH=Al(OH)3↓+3NaCl,②AlCl3+4NaOH=NaAlO2+3NaCl。
当a∶b≥1∶3时,只发生反应①,二者恰好反应时得到沉淀为amol或![]() mol,氯化铝过量时,得到沉淀小于amol,可能为
mol,氯化铝过量时,得到沉淀小于amol,可能为![]() mol;
mol;
当a∶b≤1∶4时,只发生反应②,没有沉淀生成,即沉淀为0;
当1∶3<a∶b<1∶4时,发生反应①②,则:
AlCl3 + 3NaOH = Al(OH)3↓+3NaCl
xmol 3xmol xmol,
AlCl3 + 4NaOH = NaAlO2+3NaCl,
(a-x)mol 4(a-x)mol
则3xmol+4(a-x)mol=b,解得x=(4a-b),即沉淀为(4a-b)mol,由于部分铝离子转化为氢氧化铝沉淀,可能为![]() mol;
mol;
由氢氧根守恒可知,氢氧化铝的物质的量不可能等于NaOH物质的量,即沉淀不能为bmol,
综上分析可知,沉淀可能为①a mol、③![]() mol、④
mol、④![]() mol、⑤0、⑥(4a-b)mol,不可能为②b mol,故答案为:②。
mol、⑤0、⑥(4a-b)mol,不可能为②b mol,故答案为:②。


科目:高中化学 来源: 题型:
【题目】一定温度下,0.1mol N2和0.3molH2在恒容的密闭容器中发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0下列说法不正确的是
2NH3(g) △H<0下列说法不正确的是
A. 达到平衡状态时,v正(NH3): v逆(N2)=2 : 1
B. c(N2):c(H2):c(NH3)=1:3:2时,说明反应已达到平衡状态
C. 容器内的压强不再变化时,说明反应已达到平衡状态
D. 升高温度时,v正(NH3)增大,v逆(NH3)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01000 mol·L-1的盐酸滴定0.01000 mol·L-1NaA溶液20.00mL。滴定曲线如图所示,下列说法正确的是
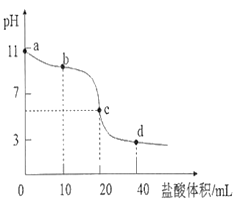
A. a点到d点的过程中,等式c(HA)+c(A—)=0.01000 mol·L—1恒成立
B. b点时,溶液中微粒浓度大小关系为:c(A—)>c(Cl —)>c(HA)>c(OH—)>c(H+)
C. c点时,溶液中微粒浓度存在关系:c(Na+)+c(H+) = c(HA)+c(OH—)+2c(A—)
D. d点时,溶液中微粒浓度存在关系:c(OH—)+c(A—)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
![]()
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B. 将容器体积变为20L,Z的平衡浓度变为原来的![]()
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题:
(1)画出Li2O的电子式________________________
(2)用电子式表示CO2分子的形成过程_________________________________________
(3)画出N2分子的结构式_________________
(4)写出全部是由H、O、S、K四种元素形成的两种盐相互反应的离子方程式__________
(5)第3周期的两种金属氧化物对应的水化物间能相互发生反应,写出其化学反应方程式_____________
(6)如图是元素周期表的一个方格  ,其中19.00的意义是___________
,其中19.00的意义是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 久置的氯水PH值变小
B. 向稀盐酸中加入少量蒸馏水,溶液中氢离子浓度降低
C. 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率
D. 工业生产硫酸过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com