
【题目】(1)回答下列问题:
①处于基态的Ca和Fe原子,下列参数前者小于后者的是_________;
a. 最外层电子数 b. 未成对电子数 c. 第一电离能 d. 原子半径
②有文献表明,迄今为止(至2016年)除氦外,所有其他稀有气体元素都能形成化合物。试简要说明未能制得氦的化合物的理由 _______________________。
(2)H和N可以形成多种化合物。
①已知联氨(N2H4)的物理性质与水接近,其原因是_____________________;
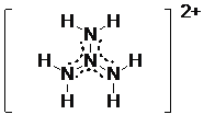
②计算表明: N4H62+ 的一种结构如图所示,氢原子只有一种化学环境,氮原子有两种环境,其中的大 π键可表示为_________________。
(3)晶体X只含钠、镁、铅三种元素。在不同的温度和压力下,晶体X呈现不同的晶相。
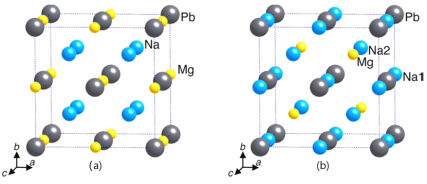
①γ-X 是立方晶系的晶体。铅为立方最密堆积,其余两种原子有选择的填充铅原子构成的四面体空隙和八面体空隙。在不同的条件下,γ-X 也呈现不同的结构,其晶胞如图所示。X的化学式为_____________;在(b)型晶胞中,边长为a pm,距离Pb最短的Na有_______个,长度为_______pm(用a表示);Na填充了晶胞中铅原子构成四面体空隙的百分比为________和八面体空隙的百分比为________。已知(a)型晶胞的边长为770 pm,则该型晶体的密度为_________g·cm-3。(只列出计算式)
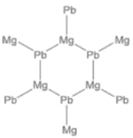
②α-X是一种六方晶系的晶体,而在α-X中,镁和铅按 1:1 的比例形成类似于石墨的层状结构,钠填在层间。试画出一层α-X 的结构__________。
【答案】bc 基态氦原子具有唯一全充满的1s电子层,半径较小,具有较高的第一电离能,所以难以形成化合物 联氨分子间能形成较多氢键 ![]() Na2MgPb 4
Na2MgPb 4 ![]() a 50% 100%
a 50% 100% ![]()
【解析】
(1)①根据基态的Ca和Fe原子核外电子排布式分析判断;
②根据基态氦原子核外电子排布结构分析判断;
(2)①联氨(N2H4)的分子中的氮原子可与氢原子形成氢键;
②根据N4H62+的结构示意图,四个氮原子形成六电子的大π键;
(3)①结合原子在晶胞中的位置关系,利用均摊法计算书写分子式;在(b)型晶胞中,体对角线![]() 处的Na距离Pb最短据此计算距离;在(b)型晶胞中,Na填充了晶胞中铅原子构成的四面体有8个,其中只有4个四面体中填充了Na,铅原子构成八面体只有一个,且Na原子在八面体的体心;根据晶胞密度计算公式ρ=
处的Na距离Pb最短据此计算距离;在(b)型晶胞中,Na填充了晶胞中铅原子构成的四面体有8个,其中只有4个四面体中填充了Na,铅原子构成八面体只有一个,且Na原子在八面体的体心;根据晶胞密度计算公式ρ=![]() 进行解答;
进行解答;
②α-X是一种六方晶系的晶体,而在α-X中,镁和铅按 1:1 的比例形成类似于石墨的层状结构,钠填在层间,则层内只有镁和铅。
(1)①基态的Ca原子的核外电子排布式为1s22s22p63s23p64s2,基态Fe原子核外电子排布式为:1s22s22p63s23p63d64s2,
a.二者最外层电子数相等,故a不符合题意;
b.Ca原子没有未成对电子,Fe原子有4个未成对的电子,故b符合题意;
c.Ca与Fe同周期,同周期元素第一电离能从左至右呈增大的趋势,Ca原子核外电子排布处于全充满稳定状态,第一电离能比相邻元素大,但铁原子与钙不相邻,则第一电离能Ca<Fe,故c符合题意;
d.Ca与Fe同周期,电子层数相同,核电荷数越大,原子半径越小,则原子半径:Ca>Fe,故d不符合题意;
答案选bc;
②基态氦原子核外电子排布式为1s2,基态氦原子具有唯一全充满的1s电子层,半径较小,具有较高的第一电离能,所以难以形成化合物;
(2)①联氨(N2H4)的分子中的氮原子可与氢原子形成氢键,并且分子间氢键数目较多,水分子间氧原子与氢原子也能形成氢键,则联氨(N2H4)的物理性质与水接近;
②根据N4H62+的结构示意图,四个氮原子形成六电子的大π键,可表示为![]() ;
;
(3)①结合原子在晶胞中的位置关系,利用均摊法,在(a)型晶胞中,Pb位于晶胞的顶点和面心,数目为8×![]() +6×
+6×![]() =4,Na位于晶胞的体内,数目为8,Mg原子位于晶胞的棱上和体心,数目为12×
=4,Na位于晶胞的体内,数目为8,Mg原子位于晶胞的棱上和体心,数目为12×![]() +1=4,X的化学式为Na2MgPb;在(b)型晶胞中,体对角线
+1=4,X的化学式为Na2MgPb;在(b)型晶胞中,体对角线![]() 处的Na距离Pb最短,共有4个,棱长为apm,面对角线长为
处的Na距离Pb最短,共有4个,棱长为apm,面对角线长为![]() apm,则体对角线的长度为
apm,则体对角线的长度为![]() apm,距离Pb最短的Na的长度为体对角线长度的
apm,距离Pb最短的Na的长度为体对角线长度的![]() ,则长度为
,则长度为![]() apm;在(b)型晶胞中,Na填充了晶胞中铅原子构成的四面体有8个,其中只有4个四面体中填充了Na,Na填充了晶胞中铅原子构成四面体空隙的百分比为50%;铅原子构成八面体只有一个,且Na原子在八面体的体心,Na填充了晶胞中铅原子构成四面体空隙的百分比为100%;(a)型晶胞的边长为770 pm,则晶胞的体积V=(770 pm)3=(7.70×10-8)3cm3,在(a)型晶胞中,Pb位于晶胞的顶点和面心,数目为8×
apm;在(b)型晶胞中,Na填充了晶胞中铅原子构成的四面体有8个,其中只有4个四面体中填充了Na,Na填充了晶胞中铅原子构成四面体空隙的百分比为50%;铅原子构成八面体只有一个,且Na原子在八面体的体心,Na填充了晶胞中铅原子构成四面体空隙的百分比为100%;(a)型晶胞的边长为770 pm,则晶胞的体积V=(770 pm)3=(7.70×10-8)3cm3,在(a)型晶胞中,Pb位于晶胞的顶点和面心,数目为8×![]() +6×
+6×![]() =4,Na位于晶胞的体内,数目为8,Mg原子位于晶胞的棱上和体心,数目为12×
=4,Na位于晶胞的体内,数目为8,Mg原子位于晶胞的棱上和体心,数目为12×![]() +1=4,则一个晶胞中含有4个Na2MgPb;根据晶胞密度计算公式ρ=
+1=4,则一个晶胞中含有4个Na2MgPb;根据晶胞密度计算公式ρ=![]() =
=![]() ;
;
②α-X是一种六方晶系的晶体,而在α-X中,镁和铅按 1:1 的比例形成类似于石墨的层状结构,钠填在层间,则层内只有镁和铅,层内α-X 的结构为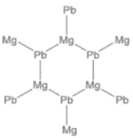 。
。


科目:高中化学 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
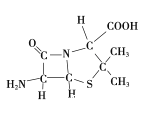
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
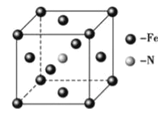
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是
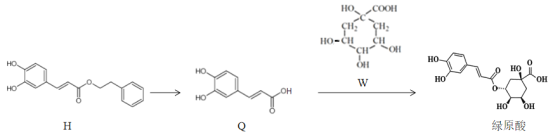
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.1mol绿原酸与足量NaHCO3溶液反应,最多放出1molCO2
D.H、Q、W均能发生氧化反应、取代反应、显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂。
(1)写出氯化铁在水中的电离方程式:_________。
(2)利用氯化铁溶液制备氢氧化铁胶体。
①下列制备氢氧化铁胶体的操作方法正确的是_______(填字母)。
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
②区别氯化铁溶液和氢氧化铁胶体的方法是___________。
(3)为了探究离子反应的本质,设计如下实验:
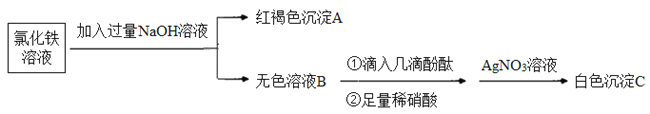
①写出生成A的离子方程式:_________。
②上述流程中,加入足量稀硝酸的目的是________。如何判定无色溶液B与稀硝酸发生了离子反应?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1.2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请按要求回答下列问题:
(1)写出A装置中的化学反应方程式_____;
(2)装置C中盛有氢氧化钠溶液,其作用是_____
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____
(4)判断该制备反应已经结束的最简单方法是_____;
(5)若产物中有少量未反应的Br2,最好用_____洗涤除去;(填正确选项前的字母)
a 水 b 亚硫酸氢钠 c 碘化钠溶液 d 乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是_____;但又不能过度冷却(如用冰水),其原因是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是

A. 用经水湿润的pH试纸测量溶液的pH
B. 将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L1NaOH溶液
C. 用装置甲蒸干AlCl3溶液制无水AlCl3固体
D. 用装置乙除去实验室所制乙烯中的少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备无水二氯化锡的主要步骤如下:
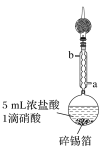
步骤1:在圆底烧瓶中加入1.20 g碎锡箔和5 mL浓盐酸、1滴硝酸,实验装置如图所示。组装好后在95 ℃ 时回流0.5 h,待圆底烧瓶中只剩余少量锡箔为止;
步骤2:将上述反应的上清液迅速转移到仪器X中,在二氧化碳气氛保护下,蒸发浓缩,冷却结晶,过滤得到二氯化锡晶体;
步骤3:在二氯化锡晶体中加入10 mL醋酸酐,即可得无水二氯化锡,过滤;
步骤4:用少量乙醚冲洗三次,置于通风橱内,待乙醚全部挥发后得到无水二氯化锡。
回答下列问题:
(1)步骤1中,圆底烧瓶中发生反应的化学方程式为___________________________________;
冷却水从接口________(填“a”或“b”)进入。实验采取的加热方式是______________;球形冷凝管上连接装有碱石灰的干燥管的目的是____________________________________。
(2)步骤2中,仪器X的名称为__________;二氧化碳气氛的作用是__________________。
(3)步骤3中,醋酸酐的作用是____________________;二氯化锡晶体在进行步骤3操作前应采取的加工措施是________,该加工措施需要仪器的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
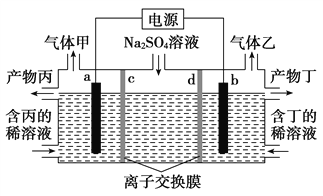
A. a极与电源的负极相连
B. 产物丙为硫酸
C. 离子交换膜d为阴离子交换膜
D. a电极反应式:2H2O+2e-===H2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com