
����Ŀ��ʵ����������������������Ҵ��Ʊ�1��2һ���������װ����ͼ��ʾ��

�й������б����£�
�Ҵ� | 1.2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g/cm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
�밴Ҫ��ش��������⣺
��1��д��Aװ���еĻ�ѧ��Ӧ����ʽ_____��
��2��װ��C��ʢ������������Һ����������_____
��3���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����_____
��4���жϸ��Ʊ���Ӧ�Ѿ��������������_____��
��5����������������δ��Ӧ��Br2�������_____ϴ�ӳ�ȥ��������ȷѡ��ǰ����ĸ��
a ˮ b ���������� c �⻯����Һ d �Ҵ�
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ����_____�����ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_____��
���𰸡�CH3CH2OH![]() CH2��CH2+H2O ��ȥ����CO2��SO2 ���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ� �۲�D����ɫ�Ƿ���ȫ��ȥ b ����������ӷ� ��Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶���������
CH2��CH2+H2O ��ȥ����CO2��SO2 ���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ� �۲�D����ɫ�Ƿ���ȫ��ȥ b ����������ӷ� ��Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶���������
��������
ʵ�����Ʊ�1��2-�������飺������ƿA�з�����Ӧ���Ҵ���Ũ����������·�����������ˮ��ȡ��ϩ���Ҵ���������ȥ��Ӧ����Ӧ����ʽΪ��CH3CH2OH![]() CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ�����Ӧ����ʽΪ��CH3CH2OH+4H2SO4(Ũ)
CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ�����Ӧ����ʽΪ��CH3CH2OH+4H2SO4(Ũ)![]() 4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2-�������飬��ӦΪ��CH2=CH2+Br-Br��CH2Br-CH2Br���Ƶ�1��2-�������顣
4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2-�������飬��ӦΪ��CH2=CH2+Br-Br��CH2Br-CH2Br���Ƶ�1��2-�������顣
��1��������������֪��װ��A�еĻ�ѧ��Ӧ����ʽΪ��CH3CH2OH![]() CH2=CH2��+H2O��
CH2=CH2��+H2O��
��2��������������֪��װ��C������Ϊ����ȥ����CO2��SO2��
��3���Ҵ���140��ʱ����ȡ����Ӧ�������ѣ�����������ϩ�������٣��ʴ�Ϊ�����ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ�
��4����ϩ���巢���ӳɷ�Ӧ��ʹ��ˮ��ɫ������۲쵽D����ɫ��ȫ��ȥ��˵�����Ʊ���Ӧ�Ѿ��������ʴ�Ϊ���۲�D����ɫ�Ƿ���ȫ��ȥ��
��5������ˮ�е��ܽ�Ƚ�С���������ǿ�����ԣ���������ԭ�����ʣ��⼸������ֻ�����������ܱ�����������ѡb��
��6�����ж����ӷ������Է�Ӧ������Ӧ����ˮ��ȴװ��D����Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶��������ܣ��ʴ�Ϊ����Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶��������ܡ�


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��и������ĸ�ʵ��װ�úͶ�Ӧ�IJ���ʵ����������a��b��c��dΪ�����缫���ɴ˿��ж����ֽ����Ļ��˳����( )
ʵ��װ�� |
|
|
|
|
����ʵ������ | a��������С b���������� | b�������ݲ��� c���ޱ仯 | d���ܽ� c�������ݲ��� | ������ָʾ�ڵ����� ������a������d�� |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣
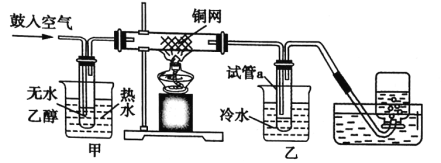
��1��ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д��ʵ������з�����Ӧ���ܻ�ѧ����ʽ��___���ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵���÷�Ӧ��__������ȡ����ȡ�����Ӧ��
��2��������ˮԡ��������ˮԡ������ˮԡ���ò���ͬ����������___���ҵ�������___��
��3����Ӧ����һ��ʱ����Թ�a�����ռ������л�����Ҫ��___��___��
��4�����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л���__��Ҫ��ȥ�����ʣ������ڻ��Һ�м���___����д��ĸ����Ȼ��ͨ�����ɡ�
A.�Ȼ�����Һ B.�� C.̼��������Һ D.���Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ѹ���Ʊ������������������·�Ӧ��KMnO4+HCl(Ũ)��KCl+MnCl2+Cl2��+H2O(δ��ƽ)���˷�Ӧ�����¾Ϳ���Ѹ�ٽ��С������Ϣ���ش��������⣺
��1��������Ӧ�б�������Ԫ��Ϊ___����ԭ������___��
��2��Fe2+Ҳ����MnO4-��Ӧ����Mn2+����Ӧ��Fe2+ת��Ϊ__����Ӧ��Fe2+����__(����������������ԭ��)�ԡ�
��3�����������ѧ����ʽ��KMnO4��MnCl2�Ļ�ѧ����������2����HCl�Ļ�ѧ��������___��
��4��ʵ����ͨ������MnO2��Ũ���Ṳ�ȷ�Ӧ�Ƶ��������ݴ˿�֪KMnO4��Cl2��MnO2�������ʵ���������ǿ������˳��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ش��������⣺
�ٴ��ڻ�̬��Ca��Feԭ�ӣ����в���ǰ��С�ں��ߵ���_________��
a. ���������� b. δ�ɶԵ����� c. ��һ������ d. ԭ�Ӱ뾶
�������ױ���������Ϊֹ����2016�꣩�����⣬��������ϡ������Ԫ�ض����γɻ�����Լ�Ҫ˵��δ���Ƶú��Ļ���������� _______________________��
��2��H��N�����γɶ��ֻ����
����֪����(N2H4)������������ˮ�ӽ�����ԭ����_____________________��
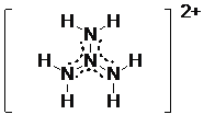
�ڼ�������� N4H62+ ��һ�ֽṹ��ͼ��ʾ����ԭ��ֻ��һ�ֻ�ѧ��������ԭ�������ֻ��������еĴ� �����ɱ�ʾΪ_________________��
��3������Xֻ���ơ�þ��Ǧ����Ԫ�ء��ڲ�ͬ���¶Ⱥ�ѹ���£�����X���ֲ�ͬ�ľ��ࡣ
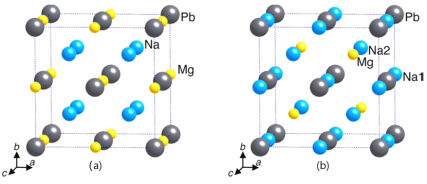
����-X ��������ϵ�ľ��塣ǦΪ�������ܶѻ�����������ԭ����ѡ������Ǧԭ�ӹ��ɵ��������϶�Ͱ������϶���ڲ�ͬ�������£���-X Ҳ���ֲ�ͬ�Ľṹ���侧����ͼ��ʾ��X�Ļ�ѧʽΪ_____________����(b)�;����У��߳�Ϊa pm������Pb��̵�Na��_______��������Ϊ_______pm����a��ʾ����Na����˾�����Ǧԭ�ӹ����������϶�İٷֱ�Ϊ________�Ͱ������϶�İٷֱ�Ϊ________����֪(a)�;����ı߳�Ϊ770 pm������;�����ܶ�Ϊ_________g��cm-3����ֻ�г�����ʽ��
����-X��һ��������ϵ�ľ��壬������-X�У�þ��Ǧ�� 1��1 �ı����γ�������ʯī�IJ�״�ṹ�������ڲ�䡣�Ի���һ����-X �Ľṹ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾʵ��װ��̽��ͭ��Ũ����ķ�Ӧ����¼ʵ���������������˵����ȷ����
�Թ� | �� | �� | �� | �� |
ʵ������ | ��Һ��Ϊ��ɫ���а�������ɫ������� | �д�����ɫ�������� | ��������ɫ�������� | Ʒ����Һ��ɫ |
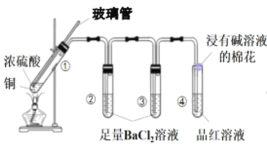
A.���а�ɫ������BaSO3
B.���п����в���Ũ����ӷ���
C.Ϊ��ȷ�����а�ɫ�����Ƿ�Ϊ����ͭ��������ȴ����Թ���ע��ˮ����
D.ʵ��ʱ������װ����ͨ������N2���ټ����Թܢ٣�ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ�����о�Ժ�ɹ�������һ����������ʯī˫���ӵ�أ��ɴ���������綯������ʹ�����ܣ��乤��ԭ����ͼ��ʾ���������У�ʯī�缫���������Ӳ�㷴Ӧ�������缫��������﮺Ͻ�Ӧ������������ȷ����
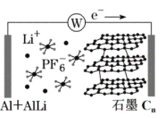
A.�ŵ�ʱ��������е�Li������˵缫�ƶ�
B.���ʱ������ӵ�Դ��������һ�˵缫��ӦΪ��AlLi-e-=Li++Al
C.�ŵ�ʱ��������ӦʽΪCn(PF6)+e-=PF6-+Cn
D.���ʱ����ת��0.2mol���ӣ������缫������5.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx��SO2�Ĵ���ת���Ի�������������Ҫ���塣
��1�����÷�Ӧ2NO(g)��2CO(g) = N2(g)��2CO2(g)����ʵ������β��������������һ�������½��и÷�Ӧ�����CO��ƽ��ת�������¶ȡ���ʼͶ�ϱ�m[m=![]() ]�Ĺ�ϵ��ͼ1��ʾ��
]�Ĺ�ϵ��ͼ1��ʾ��
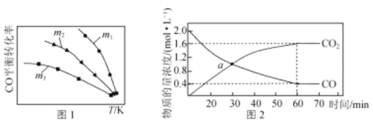
�ٸ÷�Ӧ�Ħ�H ____0(�>����<������)��
������˵����ȷ����________(����ĸ)��
A������ϵ��CO2��CO���ʵ���Ũ��֮�ȱ��ֲ���ʱ����Ӧ�ﵽƽ��״̬
B��Ͷ�ϱȣ�m1��m2��m3
C����Ͷ�ϱ�m��2ʱ��NOת������COת���ʵ�2��
D�������������еĴ��������NO��ƽ��ת����
�������¶ȵ����ߣ���ͬͶ�ϱ���CO��ƽ��ת�������������ԭ��Ϊ________��
��2������Ӧ2NO(g)��2CO(g) = N2(g)��2CO2(g)�������淴Ӧ���ʿɱ�ʾΪ��v��=k����c2(NO) ��c2(CO)��v��=k����c (N2) ��c2(CO2), k����k���ֱ�Ϊ�����淴Ӧ���ʳ����� �����¶��йء�һ���¶��£������Ϊ1L�������м���2molNO��2molCO����������Ӧ�����CO��CO2���ʵ���Ũ����ʱ��ı仯��ͼ2��ʾ����a��ʱv����v����________��
��3����ҵ�����ŷŵ�������ͬʱ����SO2��NOx��CO���������ǵ�����ÿɽ�SO2��NOx��ԭ�������ʣ�һ�������µõ�����ʵ������ͼ3Ϊ298K�������ѹ(��������ʵ�����������ѹ�ij˻�)��CO���ʵ��������Ĺ�ϵ��ͼ4ΪCO���ʵ�������Ϊ2.0%ʱ���������ѹ���¶ȵĹ�ϵ��
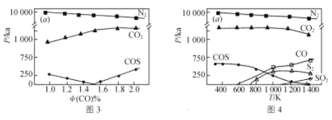
����˵������ȷ����________(����ĸ)��
A����ͬ�¶��������IJ���ΪN2������IJ�������ж���
B���¶�Խ������������Ч��Խ��
C��NOx��SO2���ױ�CO��ԭ
D����ϵ�п��ܷ�����Ӧ��2COS = S2��2CO��4CO2��S2 = 4CO��2SO2
��4��NH3����ԭ����������ĿǰӦ����㷺�����������������û���V2O5��������NH3��NO��ԭ��N2��һ�ַ�Ӧ������ͼ5��ʾ�����ܷ�Ӧ����ʽΪ________��

��5���ü�ӵ绯ѧ��ȥ��������NO��ԭ����ͼ6��ʾ���������ĵ缫��ӦʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ij�����Ŷ������һ�����������洢��ת��װ�ã�����ͼ��ʾ�����պ�K2���Ͽ�K1ʱ�����Ⲣ���ܣ��Ͽ�K2���պ�K1ʱ�����硣����˵���������
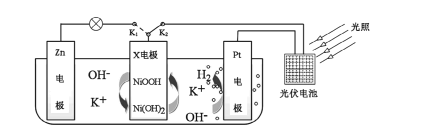
A.����ʱ����Һ��K+��Pt�缫�ƶ�
B.����ʱ��X�缫��ӦʽΪ![]()
C.����ʱ��Zn�缫������Һ��pH����
D.����ʱ��װ���е��ܷ�ӦΪ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com