
【题目】下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气泡产生 c极无变化 | d极溶解 c极有气泡产生 | 电流计指示在导线中 电流从a极流向d极 |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
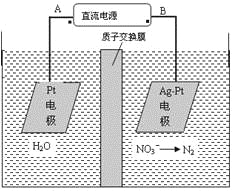
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
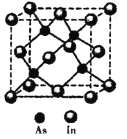
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
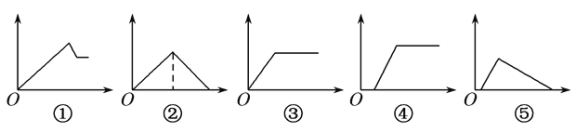
溶液 | 加入物质 | 相应序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和澄清石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合溶液 | 逐滴加入NaOH溶液至过量 |
A. ①③②④⑤ B. ③⑤④②①
C. ①②③④⑤ D. ③②④⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O工艺流程如下
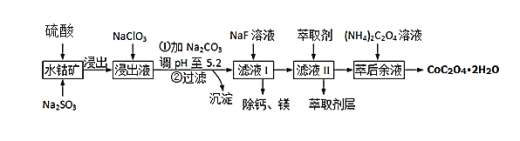
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
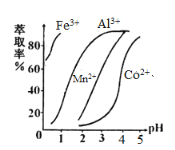
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O42H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.00molL-1NaOH溶液滴入20.00mL1.00molL-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示:
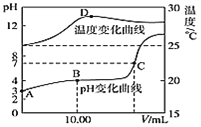
(1)计算室温时20.00mL1.00molL-1的一元酸HA的电离度α=________
(2)图中B点所示的溶液中所含各离子浓度由大到小的顺序是_________
(3)下列说法正确的是_______(填相应序号).
A.由图中可知NaOH和HA反应的![]() H>0
H>0
B.图中C点所加NaOH溶液的体积V=20.00mL
C.图中C点时溶液的KW略大于1×10-14molL-1,溶液中c(H+)=1×10-7molL-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20mL0.1molL-1Na2CO3溶液中逐滴加入0.1molL-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示,回答下列问题:
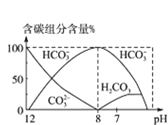
①在同一溶液中,H2CO3、HCO3-、CO32-_________(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为_______,溶液中各种离子的物质的量浓度的大小关系为______________;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4molL-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随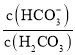 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D.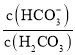 =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1.2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请按要求回答下列问题:
(1)写出A装置中的化学反应方程式_____;
(2)装置C中盛有氢氧化钠溶液,其作用是_____
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____
(4)判断该制备反应已经结束的最简单方法是_____;
(5)若产物中有少量未反应的Br2,最好用_____洗涤除去;(填正确选项前的字母)
a 水 b 亚硫酸氢钠 c 碘化钠溶液 d 乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是_____;但又不能过度冷却(如用冰水),其原因是_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com