
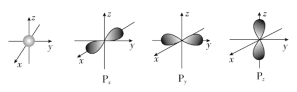
【题目】如图是s能级和p能级的原子轨道图。
试回答下列问题:
(1)s电子的原子轨道呈________形,每个s能级有________个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有3个互相________(填“垂直”或“平行”)的伸展方向。元素X的名称是________,它的最低价氢化物的电子式是________。
(3)元素Y的原子最外层电子排布式为nsn-1npn+1,Y的元素符号为________,原子的核外电子排布式为______________。
【答案】球 1 哑铃 3 2p轨道 垂直 氮
![]() S [Ne]3s23p4
S [Ne]3s23p4
【解析】
根据图中信息得到s电子、p电子的原子轨道形状和轨道数目;根据元素X的原子最外层电子排布式为nsnnpn+1,得出n值,再进行分析。
(1)s电子的原子轨道呈球形,每个s能级有1个原子轨道;p电子的原子轨道呈哑铃形,每个p能级有3个原子轨道;故答案为:球;1;哑铃;3。
(2)元素X的原子最外层电子排布式为nsnnpn+1,则n =2,因此原子中能量最高的是2p轨道电子,其电子云在空间有3个互相垂直的伸展方向。元素X价电子为2s22p3,其元素名称是氮,它的最低价氢化物为NH3,其电子式是![]() ;故答案为:2p轨道;垂直;氮;
;故答案为:2p轨道;垂直;氮;![]() 。
。
(3)s轨道最多2个电子,因此元素Y的原子最外层电子排布式为3s23p4,则Y为16号元素,其元素符号为S,原子的核外电子排布式为[Ne]3s23p4;故答案为:S;[Ne]3s23p4。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀硫酸25mL,滴定终点时消耗NaOH溶液15mL。
(1)该学生用标准0.14mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO425mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
①滴定操作的正确顺序是(用序号填写):________。
②该滴定操作中应选用的指示剂是:_______。
③在G操作中如何确定终点?________。
(2)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度______mol/L。(计算出结果到小数点后二位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
阳离子 | K+、Na+、 Cu2+、Al3+ |
阴离子 | SO42-、HCO3-、NO3-、OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B:____________、D:________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为____________。
(3)写出实验②发生反应的离子方程式:___________________、_________________。
(4)C常用作净水剂,用离子方程式表示其净水原理:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为![]()
![]() 的三种酸
的三种酸![]() 、HB和
、HB和![]() 溶液,滴定的曲线如图所示。下列判断不正确的是
溶液,滴定的曲线如图所示。下列判断不正确的是![]()
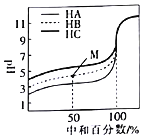
A.三种酸的电离平衡常数:![]()
B.滴定至M点时,溶液中:![]()
![]()
C.![]() 时,三种溶液中:
时,三种溶液中:![]()
![]()
D.当中和百分数达到![]() 时,三种溶液中:
时,三种溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)=2C(g)+D(s)。若经2s后测得C的浓度为1.8mol/L,下列说法正确的是
A.2s时物质A的浓度为0.9mol/L
B.用物质D表示的反应速率为0.45mol/(L·s)
C.用物质A表示的反应速率为1.8mol/(L·s)
D.2s时物质B的浓度为1.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A. 图 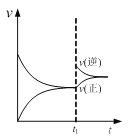 可表示N2+3H2
可表示N2+3H2![]() 2NH3的速率时间图像,t1时刻改变的条件是升高温度
2NH3的速率时间图像,t1时刻改变的条件是升高温度
B. 图 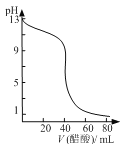 可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
C. 图 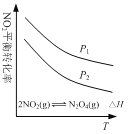 可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
D. 图 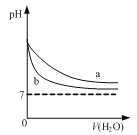 可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )

A. HR为强酸 B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
)>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
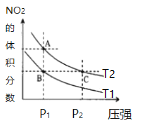
A.A点的反应速率小于C点的反应速率
B.A、C两点气体的颜色:A浅,C深
C.由状态B到状态A,可以用降温的方法
D.A、C两点气体的平均相对分子质量:A<C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com