
【题目】氮可以形成多种化合物,如NH3、N2H4、NH4NO3、NF3等。
(1)已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJmol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
则N2H4(l)+O2(g)═N2(g)+2H2O △H= _________kJmol-1;
(2)污水中的NH4+可以用氧化镁处理,发生如下反应:
MgO+H2O![]() Mg(OH)2Mg(OH)2+2NH4+
Mg(OH)2Mg(OH)2+2NH4+![]() Mg2++2NH3H2O
Mg2++2NH3H2O

①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是________________;
②剩余的氧化镁,不会对废水形成二次污染,理由是________________;
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2═2HNO2+2H2O+2H+;2HNO2+O2=2HNO3).然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体.
①上述方法中,14g铵态氮元素转化为硝态氮元素时需氧的质量为_______g。
②写出加入甲醇后反应的离子方程式________________;
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式________________;
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为________________;

(5)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。写出a电极的电极反应式__________________。
【答案】
(1)-622.2
(2)①升高温度NH3的溶解度降低,有利于NH3的逸出 ② 氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
(3)① 64 ② 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
(4)①2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O ②3N2H4![]() N2+4NH3
N2+4NH3
(5)NH4++3F--6e-=NF3+4H+
【解析】
试题分析:(1)①已知:Ⅰ.N2(g)+2H2(g)═N2H4(l)△H=+50.6kJmol-1
Ⅱ.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
根据盖斯定律,Ⅱ-Ⅰ可得:N2H4(l)+O2(g)═N2(g)+2H2O(l),则△H=-571.6kJmol-1
-50.6kJmol-1=-622.2kJmol-1
(2)①在25℃前,升高温度氮去除率增大的原因是:因为氨气溶解度随温度升高,溶解度减小,有利于NH3的逸出;
②剩余的氧化镁,是难溶于水的物质,以沉淀的形式排出,不会形成二次污染;
(3)①14g铵态氮元素物质的量为![]() =1mol,根据电子转移守恒,转化为硝态氮元素时需氧的物质的量为
=1mol,根据电子转移守恒,转化为硝态氮元素时需氧的物质的量为![]() =2mol,需要氧气质量为2mol×32g/mol=64g;
=2mol,需要氧气质量为2mol×32g/mol=64g;
②甲醇和NO3-反应转化为两种无毒气体,应是生成N2、CO2,反应还生成水,反应离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
(4)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为3N2H4![]() N2+4NH3;
N2+4NH3;
(5)由图2可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,阳极上铵根失去电子生成NF3,电极反应方程式为NH4++3F--6e-=NF3+4H+。


科目:高中化学 来源: 题型:
【题目】聚酯纤维是目前产量第一的合成纤维.它可通过如下路线合成:

(1)若W的核磁共振氢谱显示有两个峰,且峰面积之比是2 :3。
① W物质的结构简式为 。
② 生成W的反应类型为 。
(2)若G的摩尔质量是116 g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素。
① 下列叙述中不正确的有 。
a.A的同系物中可能存在顺反异构现象
b.反应I需要在NaOH的乙醇溶液中完成
c.W与A均能使酸性KMnO4溶液褪色
d.在B中滴加AgNO3溶液会马上产生淡黄色沉淀
② 完成下列化学方程式
C→D: 。
D→E: 。
C+ F→G: 。
③ J有多种同分异构体,满足以下条件J的同分异构体的个数是 ;
A.遇FeCl3溶液呈紫色 B.能发生银镜反应
C.1 mol J能与最多3 mol NaOH反应;
④ 生产中为提高产品质量,将粗品J溶于热水、趁热过滤、 ,获得J的精品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯催化脱氢制苯乙烯反应:
![]()
(1)已知:

计算上述反应的△H=________ kJ·mol-1。
(2)维持体系温度和总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=___________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)如右图所示:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 。
②控制反应温度为600℃的理由是 。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为____________。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为________(填元素符号),其原因是_________。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________,乙 ;甲高温易转化为乙的原因是__________________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为 ,该化合物加热时首先失去的组分是 ,判断理由是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:

已知:
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。

(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用所示装置探究二氧化硫的性质。(装置中固定仪器未画出)

(1)A中所装试剂为铜片和 。(填试剂名称),导管F的作用是 。(2)D中试剂为0.5 mol/L BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为 ,证明SO2具有 性。
(3)装置B用于验证SO2的漂白性,则其中所装溶液可以为 。
A.酸性高锰酸钾溶液 B.品红溶液 C.石蕊试液 D.蓝色的碘—淀粉溶液
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能原因,并设计实验验证。
可能原因: 。实验验证: 。
(5)E中Na2S溶液用于验证SO2的氧化性,预期观察到的现象为 。
(6)指出上述装置中一处明显的不足: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型的无机非金属材料,工业上制备原理如下:Al2O3+N2+3C![]() 2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
【方案1】有人想用下列A、B两个装置中的一种(在通风橱内进行)。只需进行简单而又必要的数据测定,用差量法就可测定样品中A1N的质量分数,较合理的装置是:___________(填代号)。

【方案2】取一定量(m1)的样品,用以下装置测定样品中A1N的纯度(夹持装置己略去)。

(1)上图C装置中球形干燥管的作用是___________;
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性:再加入实验药品,接下来关闭K1打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间。
请回答:I、需测定___________(填A、B、C)装置反应前后的质量变化。Ⅱ、通入氮气的目的是____________。
【方案3】按以下步骤测定样品中A1N的含量:
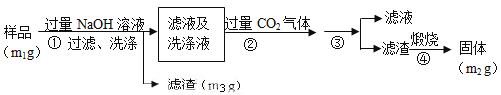
(1)步骤②生成沉淀的离子方程式为___________;
(2)步骤③的操作是___________,A1N的纯度是___________(用m1、m2、m3表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为______,B为______,C为______。
(2)E的电子式为 。
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:__ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:

(1)操作Ⅱ中,通入硫化氢至饱和的目的是______________;在溶液中用硫酸酸化至pH=2的目的是______________。
(2)滤渣Ⅱ的主要成分是______________。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______________(填仪器名称).
②判断此滴定实验达到终点的方法是______________。
③计算上述样品中FeSO47H2O的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com