
【题目】聚酯纤维是目前产量第一的合成纤维.它可通过如下路线合成:

(1)若W的核磁共振氢谱显示有两个峰,且峰面积之比是2 :3。
① W物质的结构简式为 。
② 生成W的反应类型为 。
(2)若G的摩尔质量是116 g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素。
① 下列叙述中不正确的有 。
a.A的同系物中可能存在顺反异构现象
b.反应I需要在NaOH的乙醇溶液中完成
c.W与A均能使酸性KMnO4溶液褪色
d.在B中滴加AgNO3溶液会马上产生淡黄色沉淀
② 完成下列化学方程式
C→D: 。
D→E: 。
C+ F→G: 。
③ J有多种同分异构体,满足以下条件J的同分异构体的个数是 ;
A.遇FeCl3溶液呈紫色 B.能发生银镜反应
C.1 mol J能与最多3 mol NaOH反应;
④ 生产中为提高产品质量,将粗品J溶于热水、趁热过滤、 ,获得J的精品。
【答案】
(1)①![]() ; ②取代;
; ②取代;
(2)① b d;
②C→D:![]() ;
;
D→E:OHC-CHO+4Ag(NH3)2OH![]() NH4OOC-COONH4+4Ag+6NH3+2H2O;
NH4OOC-COONH4+4Ag+6NH3+2H2O;
C+ F→G:HOOC—COOH+HOCH2CH2OH  +2H2O;
+2H2O;
③ 13;
④ 冷却、结晶。
【解析】
试题分析:W的核磁共振氢谱显示有两个峰,峰值面积比是2:3,由题给信息可知应为![]() ,由苯产生对二甲苯的反应类型是取代反应;J为
,由苯产生对二甲苯的反应类型是取代反应;J为![]() ,G的摩尔质量是116g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素,则G中N(C)=(116×41.4%)÷12=4,N(H)=[116×(141.4%55.2%)]÷1=4,N(O)=(116×55.2%)÷16=4,G的分子式为C4H4O4,由转化关系可知C、F的C原子数相等,则C为HOCH2CH2OH,D为OHC-CHO,F为HOOCCOOH,则A为CH2=CH2,B为CH2BrCH2Br,该聚酯纤维为
,G的摩尔质量是116g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素,则G中N(C)=(116×41.4%)÷12=4,N(H)=[116×(141.4%55.2%)]÷1=4,N(O)=(116×55.2%)÷16=4,G的分子式为C4H4O4,由转化关系可知C、F的C原子数相等,则C为HOCH2CH2OH,D为OHC-CHO,F为HOOCCOOH,则A为CH2=CH2,B为CH2BrCH2Br,该聚酯纤维为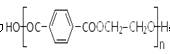 。(1)①由以上分析可知W物质的结构简式为
。(1)①由以上分析可知W物质的结构简式为![]() ;②苯和CH3Cl发生取代反应生成
;②苯和CH3Cl发生取代反应生成![]() 和HCl,反应类型是取代反应;③J为
和HCl,反应类型是取代反应;③J为![]() ,其中含有的官能团为羧基;(2)a.A为乙烯,对应同系物中可能存在顺反异构现象,如2-丁烯,正确;b.反应I为取代反应,需要在NaOH的水溶液中完成,错误;c.W为
,其中含有的官能团为羧基;(2)a.A为乙烯,对应同系物中可能存在顺反异构现象,如2-丁烯,正确;b.反应I为取代反应,需要在NaOH的水溶液中完成,错误;c.W为![]() ,与乙烯均能使酸性KMnO4溶液褪色,正确;d.B为CH2BrCH2Br,不能电离出溴离子,在B中滴加AgNO3溶液不会产生淡黄色沉淀,错误。故不正确的是b d;(3)C为HOCH2CH2OH,D为OHC-CHO,C→D的方程式为
,与乙烯均能使酸性KMnO4溶液褪色,正确;d.B为CH2BrCH2Br,不能电离出溴离子,在B中滴加AgNO3溶液不会产生淡黄色沉淀,错误。故不正确的是b d;(3)C为HOCH2CH2OH,D为OHC-CHO,C→D的方程式为![]() ;OHC-CHO含有两个醛基,可以与银氨溶液发生银镜反应产生E:NH4OOC-COONH4,所以D→E的反应方程式是:OHC-CHO+4Ag(NH3)2OH
;OHC-CHO含有两个醛基,可以与银氨溶液发生银镜反应产生E:NH4OOC-COONH4,所以D→E的反应方程式是:OHC-CHO+4Ag(NH3)2OH![]() NH4OOC-COONH4+4Ag+6NH3+2H2O;C为HOCH2CH2OH,F为HOOCCOOH,G是
NH4OOC-COONH4+4Ag+6NH3+2H2O;C为HOCH2CH2OH,F为HOOCCOOH,G是 二者可发生酯化反应,反应的方程式为HOOC—COOH+HOCH2CH2OH
二者可发生酯化反应,反应的方程式为HOOC—COOH+HOCH2CH2OH  +2H2O;③J为
+2H2O;③J为![]() ,其同分异构体具有的性质是:a.遇FeCl3溶液呈紫色,说明含有酚羟基; b.能发生银镜反应,说明含有醛基; C.1mol J能与最多3molNaOH反应,则对应的同分异构体有苯环上有-OH、-CH2OH、-OOCH等官能团,共10种同分异构体,或苯环含有2个官能团,分别为-OH和-OOCCHO,有邻、间、对3种,因此符合条件的J的同分异构体共13种;④从溶液中得到晶体,应进行溶于热水、过滤、冷却结晶等操作,故答案为:冷却、结晶。
,其同分异构体具有的性质是:a.遇FeCl3溶液呈紫色,说明含有酚羟基; b.能发生银镜反应,说明含有醛基; C.1mol J能与最多3molNaOH反应,则对应的同分异构体有苯环上有-OH、-CH2OH、-OOCH等官能团,共10种同分异构体,或苯环含有2个官能团,分别为-OH和-OOCCHO,有邻、间、对3种,因此符合条件的J的同分异构体共13种;④从溶液中得到晶体,应进行溶于热水、过滤、冷却结晶等操作,故答案为:冷却、结晶。


科目:高中化学 来源: 题型:
【题目】下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,完成18~19题。

(1)下列叙述正确的是
A.装置Ⅰ在反应过程中自始至终只生成红棕色气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+
(2)下列与反应原理相关的叙述不正确的是
A.装置Ⅰ中不可能发生如下反应:Fe+2Fe3+= 3Fe2+
B.装置Ⅱ在反应结束时溶液中存在Fe2+
C.装置Ⅰ的溶液若换为稀硝酸,则腐蚀过程与原装置不同
D.装置Ⅱ中的铁丝能发生电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO2(g)![]() N2O4(g) △ H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g) △ H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。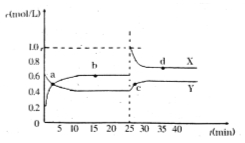
(1)a、b、c、d四个点中,化学反应处于平衡状态的是 点。
(2)b点平衡常数的表达式为 。
(3)b、d两点所表示的反应体系中,气体颜色由深的是 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。

(1)气密性检验的操作过程是________________。
(2)为快速得到乙醇气体,可采取的方法是________________;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是________________(填写编号);
a.取下小试管
b.移去酒精灯
c.将导管从乳胶管中取下
d.以上都可以
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验.
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
②经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是________________;关于M 中铁元素价态的判断正确的是________________(填写编号).
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3价,0价和+2价铁至少有一种
(4)若M的成份可表达为FexOy,用CO还原法定量测定其化学组成.称取ag M样品进行定量测定,实验装置和步骤如下:

①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧….正确的操作顺序是________________(填写编号)
a.①⑤④③②⑥⑦⑧
b.①③⑤④②⑦⑥⑧
c.①⑤③④②⑥⑦⑧
d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中![]() =________________。
=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(普通)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:

合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置a的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 (填正确答案标号)。
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。

(1)写出BA3的电子式___________;
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个取向,原子轨道呈_____形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________;
,该同学所画的电子排布图违背了___________;
(4)G位于_____族______区,该元素的核外电子排布式为___________;
(5)DE3中心原子的杂化方式为________,用价层电子对互斥理论推测其空间构型为___________;
(6)检验F元素的方法是___________,请用原子结构的知识解释产生此现象的原因___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课上,围绕硫的化合物性质进行如下探究,请根据要求回答以下问题。

(1)装置A中反应的化学方程式为________________________________。
(2)装置B用来探究SO2的漂白性,则应装的试剂是________,反应一段时间后,看到的现象是________________;若将Cl2通入B中也能看到同样的现象,则二者在反应原理上________(填“相同”或“不相同”)。
(3)装置C检验SO2具有______性(填“氧化”或“还原”)。装置C试管口棉花团应蘸有_____溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:

(1)仪器A为________(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为________;
(2)完善步骤Ⅳ涉及的离子方程式:______C2O42-+ MnO4-+ H+= Mn2++ CO2↑+ ;该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面.
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl-影响
猜想2:配制Na2C2O4标液定容时________;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl-影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液)________。
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、NH4NO3、NF3等。
(1)已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJmol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
则N2H4(l)+O2(g)═N2(g)+2H2O △H= _________kJmol-1;
(2)污水中的NH4+可以用氧化镁处理,发生如下反应:
MgO+H2O![]() Mg(OH)2Mg(OH)2+2NH4+
Mg(OH)2Mg(OH)2+2NH4+![]() Mg2++2NH3H2O
Mg2++2NH3H2O

①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是________________;
②剩余的氧化镁,不会对废水形成二次污染,理由是________________;
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2═2HNO2+2H2O+2H+;2HNO2+O2=2HNO3).然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体.
①上述方法中,14g铵态氮元素转化为硝态氮元素时需氧的质量为_______g。
②写出加入甲醇后反应的离子方程式________________;
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式________________;
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为________________;

(5)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。写出a电极的电极反应式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com