
【题目】有机物A、D均是重要的有机合成中间体,D被称为佳味醇![]() ,具有特殊芳香的液体,也可直接作农药使用。如图所示的是由苯酚为原料合成A、D的流程:
,具有特殊芳香的液体,也可直接作农药使用。如图所示的是由苯酚为原料合成A、D的流程:
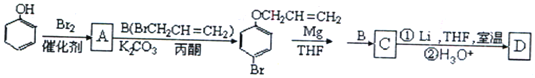
已知:
①BrR1![]() BrMR1
BrMR1![]() R1—R2(THF为一种有机溶剂)
R1—R2(THF为一种有机溶剂)
②C6H5—O—R![]() C6H5—OH
C6H5—OH
请回答下列问题:
(1)写出A、C的结构简式 ______、______。
(2)![]() 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有______ 种氢处于不同的化学环境。
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有______ 种氢处于不同的化学环境。
(3)指出![]() 的有机反应类型 ______。
的有机反应类型 ______。
(4)化合物B经过下列转化,可合成用于制造树脂、合成橡胶乳液的有机原料丙烯酸:
B![]() E
E ![]() F
F![]()
![]()
![]()
![]() G
G
①设置反应②、⑥的目的是 ______。
②写出反应③的化学反应方程式 ______。
③写出反应④的化学反应方程式 ______。
④G与甲醇反应生成的酯H是生产丙烯酸树脂的一种重要单体,写出H聚合的化学反应方程式 _________________。
(5)写出符合下列要求的化合物D的所有同分异构体的结构简式______________。
①遇FeCl3溶液呈紫色;
②苯环上有两个取代基,且苯环上的一氯代物有两种。
【答案】![]()
 2 取代反应 保护碳碳双键 2HOCH2CH2CH2Br+O2
2 取代反应 保护碳碳双键 2HOCH2CH2CH2Br+O2![]() 2BrCH2CH2CHO+2H2O BrCH2CH2CHO+2Cu(OH)2
2BrCH2CH2CHO+2H2O BrCH2CH2CHO+2Cu(OH)2![]() BrCH2CH2COOH+Cu2O↓+2H2O
BrCH2CH2COOH+Cu2O↓+2H2O ![]()
【解析】
根据A的生成物的结构简式可看出苯酚和溴反应时,溴原子在羟基的对位上,即A的结构简式为![]() ,根据已知信息①可知C的结构简式是
,根据已知信息①可知C的结构简式是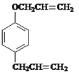 ,由信息②可知D的结构简式是
,由信息②可知D的结构简式是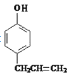 ,(4)中B的结构简式是CH2=CHCH2Br,B发生水解反应生成E为CH2=CHCH2OH,E和HBr发生加成反应生成F,则F是BrCH2CH2CH2OH或CH3CH(Br)CH2OH,F氧化生成BrCH2CH2CHO或CH3CH(Br)CHO,继续被氧化、酸化生成BrCH2CH2COOH或CH3CH(Br)COOH,最后通过消去反应生成G,则G结构简式是CH2=CHCOOH。因为在氧化羟基的同时也易氧化碳碳双键所以为了保护碳碳双键,才设置反应②和⑥,G与甲醇反应生成的酯H,则H结构简式是CH2=CHCOOCH3,分子中含有碳碳双键,可发生加聚反应生成高聚物。
,(4)中B的结构简式是CH2=CHCH2Br,B发生水解反应生成E为CH2=CHCH2OH,E和HBr发生加成反应生成F,则F是BrCH2CH2CH2OH或CH3CH(Br)CH2OH,F氧化生成BrCH2CH2CHO或CH3CH(Br)CHO,继续被氧化、酸化生成BrCH2CH2COOH或CH3CH(Br)COOH,最后通过消去反应生成G,则G结构简式是CH2=CHCOOH。因为在氧化羟基的同时也易氧化碳碳双键所以为了保护碳碳双键,才设置反应②和⑥,G与甲醇反应生成的酯H,则H结构简式是CH2=CHCOOCH3,分子中含有碳碳双键,可发生加聚反应生成高聚物。
根据A的生成物的结构简式可看出苯酚和溴反应时,溴原子在羟基的对位上,即A的结构简式为![]() ,根据已知信息①可知C的结构简式是
,根据已知信息①可知C的结构简式是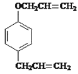 ,由信息②可知D的结构简式是
,由信息②可知D的结构简式是 。
。
(1)由上述分析可知,A的结构简式为![]() ,C的结构简式为
,C的结构简式为 ;
;
(2)![]() 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有2种氢处于不同的化学环境;
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有2种氢处于不同的化学环境;
(3)![]() 转化中A中羟基中H原子被取代,反应属于取代反应;
转化中A中羟基中H原子被取代,反应属于取代反应;
(4)化合物B的结构简式是CH2=CHCH2Br,B发生水解反应生成E为CH2=CHCH2OH,E和HBr发生加成反应生成F,则F是BrCH2CH2CH2OH或CH3CH(Br)CH2OH,F氧化生成
①设置反应②和⑥的目的是:保护碳碳双键;
②反应③的化学反应方程式为:2HOCH2CH2CH2Br+O2![]() 2BrCH2CH2CHO+2H2O;
2BrCH2CH2CHO+2H2O;
③反应④的化学反应方程式为BrCH2CH2CHO+2Cu(OH)2![]() BrCH2CH2COOH+Cu2O↓+2H2O;
BrCH2CH2COOH+Cu2O↓+2H2O;
④H结构简式是CH2=CH-COOCH3,分子中含有碳碳双键,可发生加聚反应生成高聚物,H聚合的化学反应方程式为![]() ;
;
(5)化合物D( )的同分异构体符合下列条件:①遇FeCl3溶液呈紫色,说明含有酚羟基;②苯环上有两个取代基,且苯环上的一氯代物有两种,两个不同的取代基处于对位,符合条件的同分异构体有:
)的同分异构体符合下列条件:①遇FeCl3溶液呈紫色,说明含有酚羟基;②苯环上有两个取代基,且苯环上的一氯代物有两种,两个不同的取代基处于对位,符合条件的同分异构体有: 。
。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】(1)写出用键线式表示的有机物的分子式![]() 分子式:______。
分子式:______。
(2)![]() 分子中最多有 ___________个原子共直线;最多有___________个原子共平面。
分子中最多有 ___________个原子共直线;最多有___________个原子共平面。
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为___________; A与溴的四氯化碳溶液反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究![]() 与
与![]() 能否反应产生
能否反应产生![]() 。
。
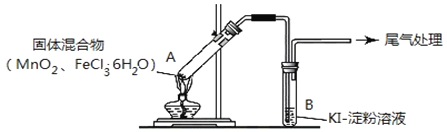
实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验1 | 按如图所示加热 |
|
实验2 | 把A中的混合物换为 B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
![]() 实验1和实验2产生白雾的原因是__________________________________________。
实验1和实验2产生白雾的原因是__________________________________________。
![]() 实验2说明黄色气体中含有___________
实验2说明黄色气体中含有___________![]() 填化学式
填化学式![]() 则实验1中
则实验1中![]() 的现象也可能是发生了另一个离子反应,则其离子方程式为_________________________________________。
的现象也可能是发生了另一个离子反应,则其离子方程式为_________________________________________。
![]() 为进一步确认黄色气体中含有
为进一步确认黄色气体中含有![]() ,该学习小组对实验1提出两种改进方案:
,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出![]() 。
。
则方案1中C中盛放的试剂是______;方案2中检验![]() 的试剂名称是______,选择NaBr溶液的依据是______________________________________________________。
的试剂名称是______,选择NaBr溶液的依据是______________________________________________________。
![]() 实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_________________________________________,用离子方程式表示尾气处理的方式___________________________________。
实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_________________________________________,用离子方程式表示尾气处理的方式___________________________________。
![]() 该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是____________________。请你设计实验方案验证此猜想___________________________________________________________________________________________________________________________________________________。
该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是____________________。请你设计实验方案验证此猜想___________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为______________________________________该反应类型______________其中浓H2SO4的作用是_________________和_________________
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置
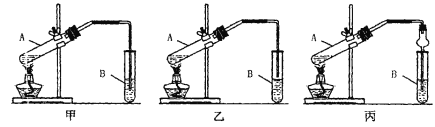
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__________(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是_____________
[实验步骤]①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4 充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验。
[问题讨论]
(1)步骤①装好实验装置,加入样品前还应检查_________________
(2)试管B中饱和Na2CO3溶液的作用是_________________________
(3)从试管B中分离出乙酸乙酯的实验操作是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,若t1时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是()
C+D,若t1时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是()
A.A、B、C是气体,D不是气体B.C、D是气体,A、B有一种是气体
C.C、D有一种是气体,A、B都不是气体D.A、B是气体,C、D有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。


下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
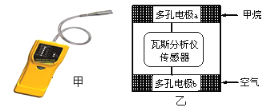
【题目】有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来,其装置如图乙所示,ab间充有固体电解质Y2O3-Na2O,允许O2-自由移动。下列叙述正确的是
A.瓦斯分析仪工作时,电池内电路中, O2-由电极a流向电极b
B.电池外电路中电子由正极流向负极
C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =____mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量_____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =______;
(4)原混合气体中,a∶b =_____;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= ______;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com