
【题目】饱和氯水长期放置后,下列成分在溶液中会增加的是( )
A.Cl2B.HClC.HClOD.H2O
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:
(1)E元素基态原子的M层有种能量不同的电子;EO2分子的立体构型为 , 其VSEPR模型名称为 .
(2)A元素的名称为 , 其基态原子价电子排布图为 .
(3)区分晶体与非晶体最可靠的科学方法是对固体进行;G与BD能形成挥发性液体G(BD)5 , 则其属于晶体.G常见晶体结构为体心立方堆积,其中G原子在二维平面里放置时的配位数为 . 某种含G化合物的晶胞如图所示,该晶体的密度为ρ g/cm3 , 则NA可以表示为(用含ρ、a、b的式子表示,不必化简) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由E转化为对甲基苯乙炔( ![]() )的一条路线如图:
)的一条路线如图: 
(1)①反应中所加试剂是; ③的反应类型是 .
(2)写出G的结构简式: .
(3)写出两种同时符合下列条件的E的同分异构体的结构简式:、 . ①属于芳香醛; ②苯环上有两种不同环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g);△H<0的平衡常数为K,下列说法正确的是( )
A.增加A的量,平衡正向移动,达到新平衡时K值增大
B.升高温度,K值增大
C.K越大,说明该反应的进行程度越大
D.该反应的K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示装置验证同主族元素非金属性的变化规律。回答下列问题:

(1)仪器A的名称为_______,干燥管D的作用是________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,实验时观察到C溶液中现彖为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加______(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.01molL﹣1HA溶液中逐滴加入0.02molL﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( ) 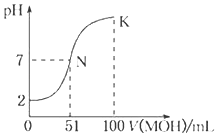
A.MOH为一元强碱HA为一元强酸
B.K 点对应的溶液中:c(M+)+c(MOH)=c(A﹣)
C.K点对应的溶液中:c(MOH)+c(OH﹣)﹣c(H+)=0.005molL﹣1
D.N点水的电离程度小于K点水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
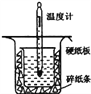
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是___________________。
(2)若改用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应与上述实验相比,所放出的热量_____________(填“相等”“不相等”),若实验操作均正确,则所求中和热______(填“相等”“不相等”)
(3) 写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):_____________________________________。
(4)某学生实验记录数据如下:
实验 | 起始温度t1/℃ | 终止温度t2/℃ | |
序号 | 硫酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________(结果保留一位小数)。
(5)上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________________________。
a.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.实验装置保温、隔热效果差
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com