
【题目】某同学利用下图所示装置验证同主族元素非金属性的变化规律。回答下列问题:

(1)仪器A的名称为_______,干燥管D的作用是________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,实验时观察到C溶液中现彖为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加______(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶。
【答案】 分液漏斗 防止倒吸 变蓝 NaOH溶液 Na2SiO3 饱和NaHCO3
【解析】(1)仪器A为分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;正确答案: 分液漏斗;防止倒吸。
(2)浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性,可与碘化钾反应生成碘,因淀粉遇碘变蓝色,则可观察到溶液变蓝,氯气有毒,不能排放到空气中,可与氢氧化钠溶液反应而被吸收;正确答案:变蓝;NaOH溶液 。
(3)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳与碳酸氢钠溶液不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,正确答案: Na2SiO3 ;饱和NaHCO3。


科目:高中化学 来源: 题型:
【题目】已知:R﹣CH=CH﹣O﹣R′ ![]() R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图:
R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图: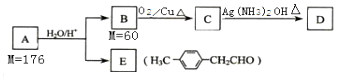
请回答下列问题:
(1)A的分子式为 , B的名称是 .
(2)写出C→D反应的化学方程式: .
(3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列化学方程式,并标明反应类型.
(1)CH4+Cl2![]() _______________,______________;
_______________,______________;
(2)CH2=CH2+Br2→_______________,______________;
(3)![]() _______________,______________。
_______________,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中几种短周期元素的原子半径及主要化合价,回答下列问题:
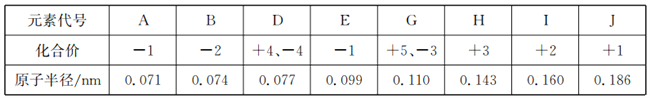
(1)元素D组成的常见单质有两种,分别是_______、________(写名称)。
(2)用电子式表示IE2的形成过程:_________________________。
(3)A、H、J的离子半径由大到小顺序是_________(用离子符号表示)。
(4)78 g J2B2与足量的水反应生成_______L(标准状况下)气体。
(5)元素E的单质与水反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)在一定温度下,容器内某一反应中M,N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( ) 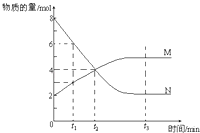
A.反应的化学方程式为:2 NM
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3Mg (OH)25H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下方案: 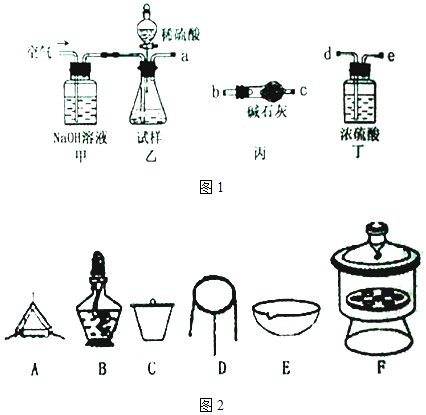
方案I 取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为 .
(2)仪器接口的连接顺序为(装置如图1可以重复使用)a , 丁的作用是 .
(3)当样品充分反应完后,缓慢通入空气的目的是 .
(4)方案 II①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g 下列仪器如图2中,该方案不会用到的是 .
(5)判断样品完全分解的方法是;本实验至少需要称量次.
(6)有同学认为方案 II高温煅烧的过程中会发生4MgCO3+SiO2 ![]() MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点正确吗?(填“正确”或“错误”)请说明理由: .
MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点正确吗?(填“正确”或“错误”)请说明理由: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com