
【题目】A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:
(1)E元素基态原子的M层有种能量不同的电子;EO2分子的立体构型为 , 其VSEPR模型名称为 .
(2)A元素的名称为 , 其基态原子价电子排布图为 .
(3)区分晶体与非晶体最可靠的科学方法是对固体进行;G与BD能形成挥发性液体G(BD)5 , 则其属于晶体.G常见晶体结构为体心立方堆积,其中G原子在二维平面里放置时的配位数为 . 某种含G化合物的晶胞如图所示,该晶体的密度为ρ g/cm3 , 则NA可以表示为(用含ρ、a、b的式子表示,不必化简) 
【答案】
(1)2; V形;平面三角形
(2)铬; 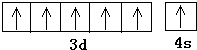
(3)X﹣射线衍射实验;分子;4; ![]()
【解析】解:A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多,外围电子排布为3d54s1,则A为Cr;B基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则B为碳元素;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则D为O元素;E的基态原子M层有6种运动状态不同的电子,则E为S元素; G在周期表中位于第8列,则G为Fe;H的原子序数比G大3,则H为Cu,(1)E的基态原子M层有6种运动状态不同的电子,外围电子排布为3s23p4,3s能级2个电子能量相同,3p能级4个电子能量相同,3s与3p能级能量不同,E元素基态原子的M层有2种能量不同的电子;SO2分子中S原子孤电子对= ![]() =1,价层电子对数=2+1=3,故SO2分子立体构型为V形,其VSEPR模型名称为平面三角形,
=1,价层电子对数=2+1=3,故SO2分子立体构型为V形,其VSEPR模型名称为平面三角形,
所以答案是:2;V形;平面三角形;(2)由上述分析可知,A元素的名称为铬,外围电子排布为3d54s1,其基态原子价电子排布图为 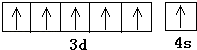 ,
,
所以答案是:铬; 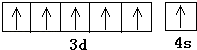 ;(3)区分晶体与非晶体最可靠的科学方法是对固体进行X﹣射线衍射实验;Fe与CO能形成挥发性液体Fe(CO)5,熔沸点很低,则其属于分子晶体;
;(3)区分晶体与非晶体最可靠的科学方法是对固体进行X﹣射线衍射实验;Fe与CO能形成挥发性液体Fe(CO)5,熔沸点很低,则其属于分子晶体;
Fe常见晶体结构为体心立方堆积,Fe原子在二维平面里放置为非密致层,Fe原子的配位数4;
由某种G化合物的晶胞图结构可知,晶胞中Fe原子位于面上及棱上,晶胞中Fe原子数目=4× ![]() +6×
+6× ![]() =4,S原子位于晶胞内部,S原子数目=8,Cu原子位于体心、面上及顶点,Cu原子数目=8×
=4,S原子位于晶胞内部,S原子数目=8,Cu原子位于体心、面上及顶点,Cu原子数目=8× ![]() +1+4×
+1+4× ![]() =4,故该化合物为CuFeS2,晶胞质量=
=4,故该化合物为CuFeS2,晶胞质量= ![]() g,晶胞体积=a×10﹣10cm×a×10﹣10cm×b×10﹣10cm=a2b×10﹣30cm3,该晶体的密度为ρ g/cm3,故
g,晶胞体积=a×10﹣10cm×a×10﹣10cm×b×10﹣10cm=a2b×10﹣30cm3,该晶体的密度为ρ g/cm3,故 ![]() g=ρ g/cm3×a2b×10﹣30cm3,解得NA=
g=ρ g/cm3×a2b×10﹣30cm3,解得NA= ![]() ,
,
所以答案是:X﹣射线衍射实验;分子;4; ![]() .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以溴乙烷为原料制备乙二醇,下列方案合理的是( )
A.CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH2═CH2
CH2═CH2 ![]() CH2BrCH2Br
CH2BrCH2Br ![]() 乙二醇
乙二醇
B.CH3CH2Br ![]() CH2BrCH2Br
CH2BrCH2Br ![]() 乙二醇
乙二醇
C.CH3CH2Br ![]() CH2═CH2
CH2═CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH2BrCH2Br
CH2BrCH2Br ![]() 乙二醇
乙二醇
D.CH3CH2Br ![]() CH2═CH2
CH2═CH2 ![]() CH2BrCH2Br
CH2BrCH2Br ![]() 乙二醇
乙二醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为 ![]() Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)= ![]() Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=、CO的平衡转化率=:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:R﹣CH=CH﹣O﹣R′ ![]() R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图:
R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图: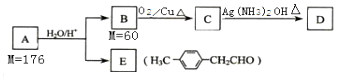
请回答下列问题:
(1)A的分子式为 , B的名称是 .
(2)写出C→D反应的化学方程式: .
(3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com