
【题目】在恒温、恒容条件下,能使A(g)+B(g)C(g)+D(s) 正反应速率增大的措施是
A. 减小C或D的浓度 B. 再加入一定量D
C. 减小B的浓度 D. 增大A或B的浓度
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
Ⅰ.工业上制备连二亚硫酸钠的流程如下:

请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
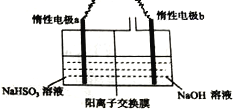
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 molL-1Na2S2O4溶液在空气中的pH变化如下图所示;
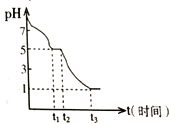
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ molL-1(填具体数值,不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于第三周期从左到右的主族元素,下列说法中不正确的是( )
A.原子半径逐渐减小
B.电子层数逐渐增多
C.最高正化合价逐渐增大
D.元素的非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是

A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) ![]() CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。

由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是_______________________________________。由图2可知,P点时平衡常数K=______(保留2位有效数字)。Q点转化率高于P点的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

请根据混合物分离或提纯原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ___________;(2)用自来水制取蒸馏水 ___________;(3)分离植物油和水 ___________;(4)与海水晒盐原理相符的是 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色能源是指使用过程中不排放或排放极少污染物的能源,如一次能源中的水能、地热能、天然气等;二次能源中的电能、氢能等。下列能源属于绿色能源的是
①太阳能②风能③石油④煤⑤潮汐能⑥木材
A.①②③B.③④⑤C.④⑤⑥D.①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com