
【题目】对于第三周期从左到右的主族元素,下列说法中不正确的是( )
A.原子半径逐渐减小
B.电子层数逐渐增多
C.最高正化合价逐渐增大
D.元素的非金属性逐渐增强
科目:高中化学 来源: 题型:
【题目】实验小组的同学对一粗盐样品进行初步提纯。所用实验仪器或用品如下

(1)D的名称是__________。
(2)提纯的步骤是:溶解、过滤、__________。
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中的“二低”是__________、__________。
(4)该实验中多次利用仪器B__________(填名称)和仪器__________(填字母序号),且该仪器使用了__________次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0达到平衡后,试回答下列问题:
2NH3(g)ΔH<0达到平衡后,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=______;若降低温度,K值将______(填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
(3)达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图所示。下列说法正确的是_______ (填序号)。
a.图I可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅱ可能是不同温度对反应的影响,且T1>T2
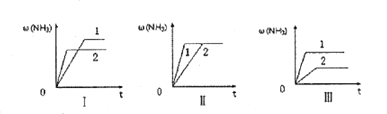
(5)A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x____y(“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为____________。
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为__________________。
(5)同温同压下,已知O2的密度为ρg/L,则CO2的密度为__________。
(6)现有下列三种气体:①32 g CH4;②约含有6.02×1023个HCl分子的氯化氢气体;③标准状况下33.6 LO2。请按物理量由小到大的顺序排列:a.质量________(填序号,下同);b.分子数目________c.相同状况下气体的体积________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容条件下,能使A(g)+B(g)C(g)+D(s) 正反应速率增大的措施是
A. 减小C或D的浓度 B. 再加入一定量D
C. 减小B的浓度 D. 增大A或B的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )

A. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
B. 此过程中铜并不被腐蚀
C. 此过程中电子从Fe移向Cu
D. 正极电极反应式为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.升高温度
B.加入适量的水
C.加入少量CuSO4溶液
D.加入浓度较大的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com