
【题目】一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0达到平衡后,试回答下列问题:
2NH3(g)ΔH<0达到平衡后,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=______;若降低温度,K值将______(填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
(3)达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
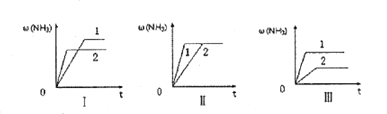
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图所示。下列说法正确的是_______ (填序号)。
a.图I可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅱ可能是不同温度对反应的影响,且T1>T2
(5)A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x____y(“>”“<”或“=”)。
【答案】 c2(NH3)/c(N2)·c3(H2) 增大 向正反应方向 不变 减小 b >
【解析】(1)反应的平衡常数表达式为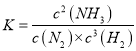 ,该反应为放热反应,降低温度应该使K值增大。
,该反应为放热反应,降低温度应该使K值增大。
(2)将容器体积缩小一半,相当于增大压强,平衡向气体物质的量减小的方向移动,所以向正反应方向移动。因为温度不变,所以K值不变。
(3)恒压下通入与反应无关的气体,相当于增大体积减小压强,平衡向逆反应方向移动,氮气的转化率减小。
(4)如果图Ⅰ表示压强的影响,根据先拐先平的原则,有P2>P1。从而得到压强越大,氨气的体积分数越小,但是增大压强平衡正向移动,氨气的体积分数应该更大,选项a错误。催化剂只改变速率不影响平衡,所以无论催化剂的性能,达平衡时氨气的体积分数相等,因为图Ⅱ中的曲线1的速率更快,说明1的催化性能更好,选项b正确。如果图Ⅲ代表温度的影响,根据先拐先平的原则,有T1>T2,从而得到温度越高,氨气的体积分数越大,但是正反应放热,升高温度平衡逆向移动,氨气的体积分数应该更小,选项c错误。
(5)刚开始的时候,两个容器是相同的,所以压强相等。A恒容,随着反应的进行压强减小(因为气体的物质的量在减小),B恒压,压强一直不变,所以达平衡时的压强B>A。因为增大压强,平衡向正反应方向移动,所以B中的平衡态更向右,氢气的物质的量更小,答案为:x>y。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】一种低成本的储能电池,电池结构如下图所示,电池工作原理为:Fe3++Cr2+ ![]() Fe2++Cr3+。下列说法正确的是( )
Fe2++Cr3+。下列说法正确的是( )
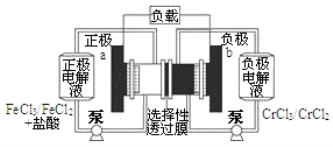
A. 电池放电时,Cl﹣从b极穿过选择性透过膜移向a极
B. 电池放电时,b极的电极反应式为Cr3++e﹣=Cr2+
C. 电池充电时,a极的电极反应式为Fe2+-e﹣=Fe3+
D. 电池充电时,电路中每通过0.1mol电子,Fe2+浓度降低0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 分子碰撞的次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
Ⅰ.工业上制备连二亚硫酸钠的流程如下:

请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
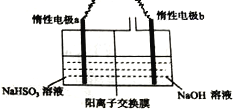
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 molL-1Na2S2O4溶液在空气中的pH变化如下图所示;
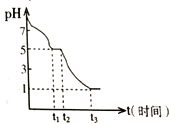
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ molL-1(填具体数值,不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态Mn原子的价电子排布式为___________。
(2)现代化学中,常利用_______________________上的特征谱线来鉴定元素。
(3)已知H2S2O8的结构如图。H2S2O8硫原子的轨道杂化方式为__________;上述反应每生成1molMnO4-,S2O82-断裂的共价键类型及其数目为_____________________;与硫酸根等电子体的分子或离子有______________________(写两种)。

(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为___________;实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是_________________。

(5)与Mn同周期相邻的元素X,价电子层有2对成对电子,其离子型氧化物晶胞如图所示。它由A、B方块组成。则该氧化物中X2+、X3+、O2-的个数比为_____________(填最简整数比);已知该晶体的密度为d g/cm3,阿伏伽德罗常数的值为NA,则晶胞参数a为_________nm (用含d和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于第三周期从左到右的主族元素,下列说法中不正确的是( )
A.原子半径逐渐减小
B.电子层数逐渐增多
C.最高正化合价逐渐增大
D.元素的非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
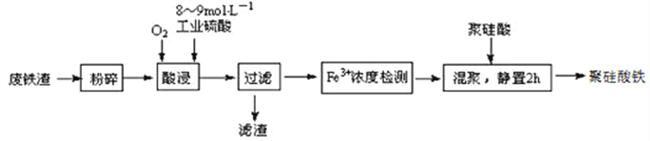
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com