
����Ŀ�����������г��ù��������������ⶨ�����̵ĺ�������Ӧԭ��Ϊ��2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
��1����̬Mnԭ�ӵļ۵����Ų�ʽΪ___________��
��2���ִ���ѧ�У�������_______________________�ϵ���������������Ԫ�ء�
��3����֪H2S2O8�Ľṹ��ͼ��H2S2O8��ԭ�ӵĹ���ӻ���ʽΪ__________��������Ӧÿ����1molMnO4-��S2O82-���ѵĹ��ۼ����ͼ�����ĿΪ_____________________����������ȵ�����ķ��ӻ�������______________________��д���֣���

��4��һ�������£�ˮ���Ӽ��ͨ���������H2O���ӽ�ϳ���ά�Ǽܽṹ�����еĶ������Ѩ�пɰ�������С���ӣ��γ�����ˮ�ϰ����ᄃ�塣��ͼ��һ����ˮ���ӹ��ɵ���ʮ������Ǽ�(��o����ʾˮ����)��������������Ϊ___________��ʵ���ñ��������������Ϊ18.8kJ��mol-1���������ۻ���Ϊ5.0kJ��mol-1����ԭ�������_________________��

��5����Mnͬ�������ڵ�Ԫ��X���۵��Ӳ���2�ԳɶԵ��ӣ��������������ᄃ����ͼ��ʾ������A��B������ɡ������������X2+��X3+��O2-�ĸ�����Ϊ_____________������������ȣ�����֪�þ�����ܶ�Ϊd g/cm3������٤��������ֵΪNA��������aΪ_________nm ���ú�d��NA�Ĵ���ʽ��ʾ��

���𰸡� 3d54s2 ԭ�ӹ��� sp3 �Ǽ��Լ� 2.5NA CCl4��SiF4������������ 30 Һ̬ˮ����Ȼ���ڴ������ 1��2��4 ![]() ��107
��107
��������(1)��ԭ������Ϊ25��������Ϊ25��ԭ�Ӻ��������Ϊ25�������������ԭ���̵ĵ����Ų�ʽΪ��[Ar]3d54s2���۵����Ų�ʽΪ��3d54s2���ʴ�Ϊ��3d54s2��
(2)�ִ���ѧ�У���������ԭ�ӹ�����������������Ԫ�أ��ʴ�Ϊ��ԭ�ӹ��ף�
(3)H2S2O8�У���ԭ�Ӽ۲���Ӷ���=�� �����Ӷ�+����ԭ���ϵŵ��Ӷ�=4+![]() (6-4��1-2)=4�����Բ�ȡsp3�ӻ����ɷ�Ӧ��֪��MnԪ�صĻ��ϼ�����(+2��+7)��SԪ�صĻ��ϼ۽���(+7��+6)������10molSO42-ת�Ƶ���10mol���ӣ���ÿ����1molMnO4-��ת�Ƶ���5mol���ӣ�S2O82-����2.5mol(��2.5NA)O-O��Ǽ��Թ��ۼ�����������ȵ�����ķ��ӻ�������CCl4��SiF4��ClO4-�ȣ��ʴ�Ϊ��sp3�ӻ����Ǽ��Լ���2.5NA��CCl4��SiF4��ClO4-�ȣ�
(6-4��1-2)=4�����Բ�ȡsp3�ӻ����ɷ�Ӧ��֪��MnԪ�صĻ��ϼ�����(+2��+7)��SԪ�صĻ��ϼ۽���(+7��+6)������10molSO42-ת�Ƶ���10mol���ӣ���ÿ����1molMnO4-��ת�Ƶ���5mol���ӣ�S2O82-����2.5mol(��2.5NA)O-O��Ǽ��Թ��ۼ�����������ȵ�����ķ��ӻ�������CCl4��SiF4��ClO4-�ȣ��ʴ�Ϊ��sp3�ӻ����Ǽ��Լ���2.5NA��CCl4��SiF4��ClO4-�ȣ�
(4)�ɴ˽ṹ��֪���˵�Ԫ�к���ˮ���ӵĸ���Ϊ��20������ÿ��ˮ�����γɵ��������2����Ԫ������ÿ��ˮ�����γ��������Ϊ![]() �����ܹ��γ������Ϊ��20��
�����ܹ��γ������Ϊ��20��![]() =30�����������������Ϊ18.8kJmol-1�������ۻ���Ϊ5.0kJmol-1��˵�����ۻ�ΪҺ̬ˮʱֻ���ƻ���һ�������������Һ̬ˮ������������ʴ�Ϊ��30��Һ̬ˮ����Ȼ���ڴ��������
=30�����������������Ϊ18.8kJmol-1�������ۻ���Ϊ5.0kJmol-1��˵�����ۻ�ΪҺ̬ˮʱֻ���ƻ���һ�������������Һ̬ˮ������������ʴ�Ϊ��30��Һ̬ˮ����Ȼ���ڴ��������
(5)��Mnͬ�������ڵ�Ԫ��X���۵��Ӳ���2�ԳɶԵ��ӣ��۵��Ӳ��Ų�ʽΪ3d6s2��XΪ��Ԫ�أ���A��B����Ľṹ��֪��A�к���O2-����ĿΪ4������Fe2+����ĿΪ4��![]() +1=
+1=![]() ��B�к���O2-����ĿΪ4������Fe2+����ĿΪ4��
��B�к���O2-����ĿΪ4������Fe2+����ĿΪ4��![]() =
=![]() ��Fe3+����ĿΪ4�����к���O2-����ĿΪ(4+4)��4=32��Fe2+����ĿΪ(
��Fe3+����ĿΪ4�����к���O2-����ĿΪ(4+4)��4=32��Fe2+����ĿΪ(![]() +
+![]() )��4=8��Fe3+����ĿΪ4��4=16��Fe 2+��Fe 3+��O2-�ĸ�����Ϊ8:16��32=1:2:4���þ���Ļ�ѧʽΪFe3O4����þ�����ܶ�Ϊd g/cm3=
)��4=8��Fe3+����ĿΪ4��4=16��Fe 2+��Fe 3+��O2-�ĸ�����Ϊ8:16��32=1:2:4���þ���Ļ�ѧʽΪFe3O4����þ�����ܶ�Ϊd g/cm3=![]() g/cm3�����a=
g/cm3�����a=![]() cm=
cm=![]() ��107nm���ʴ�Ϊ��1��2��4��
��107nm���ʴ�Ϊ��1��2��4��![]() ��107��
��107��


 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Al2��SO4����ȡAl��OH��3 �� ����ʵ��Լ��ǣ� ��
A.NaOH
B.H2SO4
C.NH3H2O
D.KOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����мȲ����ڵ���ʣ��ֲ����ڷǵ���ʵ���
A.Cl2B.CH3OHC.Ca(OH)2D.BaSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡������ܱ������з�����Ӧ: A(s) +2B(g)![]() C(g)+D(g),���������������ٷ����仯ʱ�������÷�Ӧ�Ѵﵽƽ��״̬����
C(g)+D(g),���������������ٷ����仯ʱ�������÷�Ӧ�Ѵﵽƽ��״̬����
�ٻ�������ѹǿ �ڻ��������ܶ� �۸���̬���ʵ����ʵ���Ũ��
������������ʵ��� �ݻ�������ƽ����Է�������
A. �ڢۢ� B. �٢ڢ� C. �ڢۢܢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ݻ��ɱ���ܱ�������ͨ��N2��H2,������Ӧ:N2(g)+3H2(g) ![]() 2NH3(g)��H<0�ﵽƽ����Իش���������:
2NH3(g)��H<0�ﵽƽ����Իش���������:
��1���������£���Ӧ��ƽ�ⳣ������ʽK=______;�������¶ȣ�Kֵ��______(����������������С������������)��
��2���ﵽƽ����������������䣬�����������Сһ��,ƽ�⽫____(�������淴Ӧ����������������Ӧ��������������)�ƶ���ƽ�ⳣ��K��_____ (����������������С������������)��
��3���ﵽƽ���,�ں�ѹ�����£���������ͨ�˺���(He),������ת���ʽ�___������������������С������������)��
��4����������ͬ�������и�����1molN2��3molH2,�ڲ�ͬ�����·ֱ�ﵽƽ�⣬���������������ʱ��仯��ͼ��ʾ������˵����ȷ����_______ (�����)��
a.ͼI�����Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2>P1
b.ͼ��������ͬ��ͬѹ�´����Է�Ӧ��Ӱ�죬�Ҵ�����1>2
c.ͼ�������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1>T2
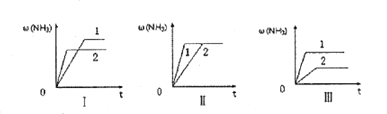
��5��A��B�����ݻ���ͬ�������и�����1molN2��3molH2,A�������ֺ��º��ݴﵽƽ��ʱ���������ʵ���Ϊx,B�������ֺ��º�ѹ�ﵽƽ��ʱ���������ʵ���Ϊy,��x____y(��>����<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ���ǣ� ��
A.ʯ��ʯ�ڸ����µķֽⷴӦ
B.��ʯ�Һ�ˮ�ķ�Ӧ
C.����������������Һ�ķ�Ӧ
D.ľ̿��������ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Ӧ�������¿��ܴ����������
A. ��ʹpH��ֽ������Һ�У�CO32-��K����Cl����Na��
B. ��ˮ���������c(OH��)��1��10��10 mol��L��1����Һ�У�NO3-��Mg2����Na����SO42-
C. ��c(OH��)/c(H��)��1��1012����Һ�У�NH4+��Fe2����Cl����NO3-
D. ![]() ��10��10 mol��L��1����Һ�У�Na����HCO3-��Cl����K��
��10��10 mol��L��1����Һ�У�Na����HCO3-��Cl����K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������ھ�ˮ��ԭ����(�����ӷ���ʽ��ʾ)��_______________________����FeCl3��Һ���ɣ����գ����õ�����Ҫ���������________________________��
��2�������ӷ���ʽ��ʾ��ĭ��������ԭ����_______________________________��
��3������ɴ���ϴ�Ӽ�ϴ�Ӳ;ߣ�ԭ����(�����ӷ���ʽ��ʾ)��________________��
��4��Ϊ�˳�ȥMgCl2������Һ�е�Fe3�������ڼ��Ƚ���������¼���MgCO3���壬���˺��ټ����������ᡣMgCO3�����ܳ�ȥFe3����ԭ����____________________��
��5����ͼ��SO2����SO3��Ӧ�����������仯������ͼ���÷�Ӧ���Ȼ�ѧ����ʽΪ____________________________________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶���������������ĵ��볣���������ж���ȷ����( )

A. �������ǿ����ϵ:HX>HY>HZ
B. ��ӦHZ+Y-===HY+Z-�ܹ�����
C. ��ͬ�¶�����0.1 mol/L��NaX��NaY��NaZ��Һ��NaZ��ҺpH���
D. ��ͬ�¶�����1 mol/L HX��Һ�ĵ��볣������0.1 mol/L HX
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com