
【题目】相同温度下,根据三种酸的电离常数,下列判断正确的是( )

A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态Mn原子的价电子排布式为___________。
(2)现代化学中,常利用_______________________上的特征谱线来鉴定元素。
(3)已知H2S2O8的结构如图。H2S2O8硫原子的轨道杂化方式为__________;上述反应每生成1molMnO4-,S2O82-断裂的共价键类型及其数目为_____________________;与硫酸根等电子体的分子或离子有______________________(写两种)。

(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为___________;实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是_________________。

(5)与Mn同周期相邻的元素X,价电子层有2对成对电子,其离子型氧化物晶胞如图所示。它由A、B方块组成。则该氧化物中X2+、X3+、O2-的个数比为_____________(填最简整数比);已知该晶体的密度为d g/cm3,阿伏伽德罗常数的值为NA,则晶胞参数a为_________nm (用含d和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.物质燃烧不一定是放热反应
C.放热的化学反应不需要加热就能发生
D.吸热反应不加热就不会发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
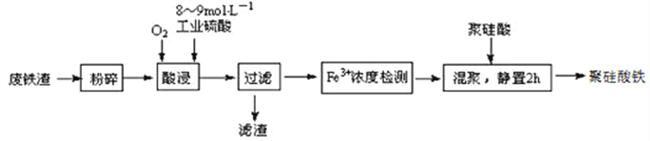
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,物质①4 g H2 ,② 33.6L CH4 ,③1mol H2O ,④3.01×1023 个 O2
(1)质量最大的是_____(填序号,下同);
(2)分子数最多的是_____;
(3)原子数最少的是_____;
(4)体积最小的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用浓H2SO4配制480mL 0.2mol·L-1的稀H2SO4。
(1)需要量取98%密度为1.84g·cm-3的浓硫酸________mL。
(2)配制时,必须使用的仪器有______(填代号),还缺少的仪器是_________、_________。
①烧杯;②10mL量筒;③20mL量筒;④托盘天平(带砝码);⑤玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是________________、_______________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”、“无影响”)。
①容量瓶没有干燥________,
②用量筒量取98%的硫酸溶液时俯视________,
③溶液转移到容量瓶后,未进行洗涤操作_________ ,
④定容时俯视容量瓶__________,
⑤如果加水超过了刻度线,取出水使液面恰好到刻度线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com