
【题目】3d 能级上最多只能排布 10 个电子依据的原则是
A.泡利不相容原理
B.洪特规则
C.能量最低原则和洪特规则
D.能量最低原则和泡利不相容原理
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________________。

(2)已知化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ·mol-1。若已知下列数据:
化学键 | HH |
|
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1 ①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1 ②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )

A. 分子式为C17H23O6
B. 不能与FeCl3溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. 1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种低成本的储能电池,电池结构如下图所示,电池工作原理为:Fe3++Cr2+ ![]() Fe2++Cr3+。下列说法正确的是( )
Fe2++Cr3+。下列说法正确的是( )
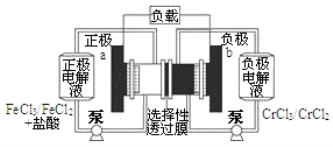
A. 电池放电时,Cl﹣从b极穿过选择性透过膜移向a极
B. 电池放电时,b极的电极反应式为Cr3++e﹣=Cr2+
C. 电池充电时,a极的电极反应式为Fe2+-e﹣=Fe3+
D. 电池充电时,电路中每通过0.1mol电子,Fe2+浓度降低0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.01mol·L-1、体积均为V1L的两种一元酸HX和HY的水溶液,加水稀释至体积为VL,测得两溶液pH随lg![]() 变化的情况如图所示,下列说法错误的是
变化的情况如图所示,下列说法错误的是
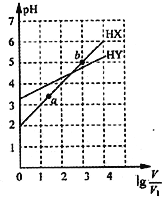
A. HY为一元弱酸 B. 将两种溶液无限稀释,由水电离产生的c(H+)相等
C. lg![]() =3时,升高温度,
=3时,升高温度,![]() 增大 D. HX 的电离程度:b>a
增大 D. HX 的电离程度:b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有中学化学常见的物质A、B、C、D、E、F、G、H,满足如下图所示转化关系。其中A、F为气体单质,A呈黄绿色,C为淡黄色固体化合物。B为生活中常见的液体化合物。回答下列问题:

(1)写出下列物质的化学式:C________,H______________。
(2)出下列化学反应方程式:
①______________________________________。
③______________________________________。
(3)写出D的一种用途__________________________。但由于D易于发生③反应而不易于保存,故生产生活中往往用A与石灰乳反应生成易于保存运输的固体,其在潮湿空气中可以反应生成D,请写出这两个反应方程式_________________,_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 分子碰撞的次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于第三周期从左到右的主族元素,下列说法中不正确的是( )
A.原子半径逐渐减小
B.电子层数逐渐增多
C.最高正化合价逐渐增大
D.元素的非金属性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com