
科目:高中化学 来源:不详 题型:实验题
 4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。 (NH4)2SO4?FeSO4?6H2O↓)根据下图回答:
(NH4)2SO4?FeSO4?6H2O↓)根据下图回答: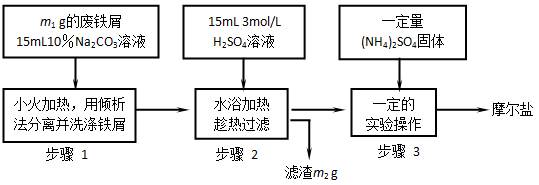

 面出现晶膜时,停止加热。为什么不能蒸干? 。需经过的实验操作包括: 、 、减压过滤(或抽滤)等得到较为干燥
面出现晶膜时,停止加热。为什么不能蒸干? 。需经过的实验操作包括: 、 、减压过滤(或抽滤)等得到较为干燥| A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
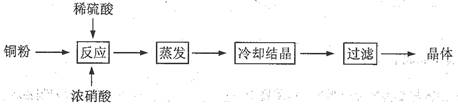
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
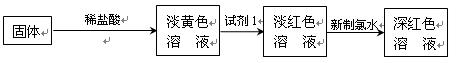
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的转化,A中Fe2+做 剂,B中Fe3+做 剂。
的转化,A中Fe2+做 剂,B中Fe3+做 剂。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 _______(填字母)。
_______(填字母)。| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式: ,待测溶液中c(Cu2+)= mol/L.
中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式: ,待测溶液中c(Cu2+)= mol/L.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
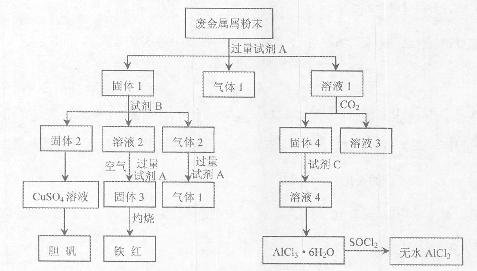
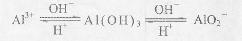
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com