
【题目】蛋白质发生的下列变化中,属于可逆的是
A. 煮熟 B. 加入浓硫酸变黑 C. 盐析 D. 加入浓硝酸变黄
科目:高中化学 来源: 题型:
【题目】0.5L 2mol/L FeCl3溶液与0.2L 5mol/L KCl溶液中的Cl﹣物质的量之比( )
A.6:5
B.3:2
C.15:2
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一可逆反应2A(g)+3B(g)![]() 4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是
4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是
A.前20 min的平均反应速率v(C)=0.1 mol/(Lmin) B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L D.B的平衡浓度c(B)=1.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= ;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“>”、“<”或“=”)。
(3)0.1mol/L的某酸H2A的pH=4,则H2A的电离方程式为 。
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸溶液的体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。
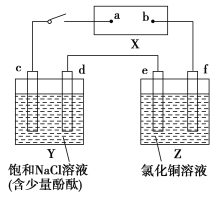
(1)①电源上b为____________极(用“正”、“负”、“阴”或“阳”填空)。
②Z槽中e为____________极(同上)。
③连接Y、Z槽线路中,电子流动的方向是d____________e(用“→”或“←”填空)。
(2)①写出c极上反应的电极反应式:_______________________________。
②写出Y槽中总反应的化学方程式:________________________________。
③写出Z槽中e极上反应的电极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H2O![]() KIO3+3H2↑,有关说法不正确的是( )
KIO3+3H2↑,有关说法不正确的是( )
A.石墨作阳极,不锈钢作阴极
B.I-在阳极放电,H+在阴极放电
C.电解过程中电解质溶液的pH变小
D.电解转移3 mol e-时,理论上可制得KIO3107 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态Fe原子有________个未成对电子。Fe3+的电子排布式为________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是

A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示金属X、Y及它们的合金Z分别与足量盐酸反应放出H2量的情况,横坐标表示消耗金属的物质的量,纵坐标表示在标准状况下产生H2的体积.下列有关合金组成的判断正确的是

A. n(Na)∶n(Fe)=2∶1 B. n(Mg)∶n(K)=1∶2
C. n(Na)∶n(Al)=1∶3 D. n(K)∶n(Al)=1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com