
| A、Ca2+、K+、OH-、Cl-、NO3- |
| B、Fe2+、H+、Br+、NO3-、Cl- |
| C、Na+、NH4+、SO42-、NO3-、Cl- |
| D、Al3+、H+、Cl-、SO42-、NO3- |


科目:高中化学 来源: 题型:
| A、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
| B、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
| C、2012年诺贝尔化学奖授予两位美国科学家罗伯特?莱夫科维茨和布莱恩?克比尔卡,以表彰他们在“G蛋白偶联受体研究”中取得的重大成就 |
| D、道尔顿、李比希、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 |
查看答案和解析>>
科目:高中化学 来源: 题型:
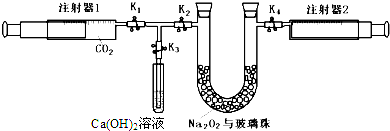
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |
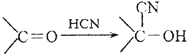
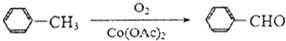
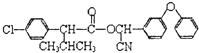 );
);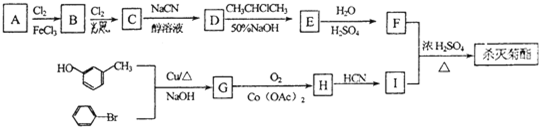
| H2O |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
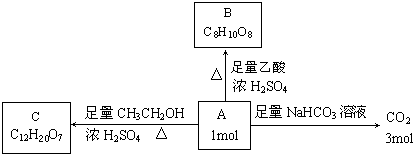
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:
(1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:| 离子 | Na+ | K+ | XO32- | SO42- |
| 浓度(mol?L-1) | 0.3 | 0.2 | 0.05 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并滴入l mL指示剂 |
| B、配制物质的量浓度溶液时,将称量好的溶质溶于盛有适量水的烧杯中,溶解后立即倾入容量瓶中,继续进行洗涤和定容 |
| C、制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再缓缓将NaOH溶液挤出 |
| D、溴乙烷和烧碱溶液共热后,将硝酸银溶液滴入水解液中,即可见到淡黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com