
| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |
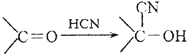
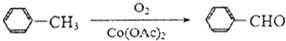
 );
);
| H2O |
| H2SO4 |
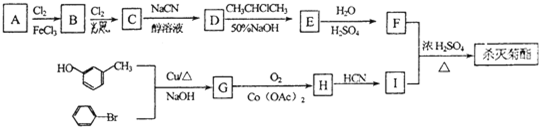
 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .E发生信息(1)中第2步反应生成F,则E为
.E发生信息(1)中第2步反应生成F,则E为 ,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为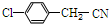 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,据此解答.
,据此解答. 、I为
、I为 .结合反应信息(2)可知H为
.结合反应信息(2)可知H为 ,G发生信息反应(3)生成H,则G为
,G发生信息反应(3)生成H,则G为 .E发生信息(1)中第2步反应生成F,则E为
.E发生信息(1)中第2步反应生成F,则E为 ,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为
,C发生信息(1)中第1步反应生成D,D与CH3CHCHCH3在50%氢氧化钠条件下反应生成E,根据E的结构可知,D为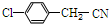 ,C为
,C为 ,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为
,A与氯气在Fe作催化剂条件下与氯气发生取代反应生成B,B与氯气在光照条件下生成C,故A为 ,B为
,B为 ,
, ,系统命名法命名,B的名称是4-甲基氯苯;由溴苯、间甲基苯酚与G的结构可知,酚羟基中的H原子被苯基取代生成G,属于取代反应,
,系统命名法命名,B的名称是4-甲基氯苯;由溴苯、间甲基苯酚与G的结构可知,酚羟基中的H原子被苯基取代生成G,属于取代反应, ,
,| 8 |
| 4 |
| 12 |
| 4 |
 +
+
| 浓H2SO4 |
| △ |
 +H2O;
+H2O; +
+
| 浓H2SO4 |
| △ |
 +H2O;
+H2O; +3NaOH
+3NaOH| 高温高压 |
| 催化剂 |
 ,
, +3NaOH
+3NaOH| 高温高压 |
| 催化剂 |
 ;
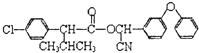
;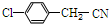 ,在硫酸存在下发生水解生成J,则J为
,在硫酸存在下发生水解生成J,则J为 ,符合下列要求的J的所有同分异构体:能水解成两种有机物,说明含有酯基,又可以银镜反应,应为甲酸形成的酯基;苯环上有两个位于间位的取代基,所以侧链为-Cl、-CH2OOCH,或-CH2Cl、OOCH
,符合下列要求的J的所有同分异构体:能水解成两种有机物,说明含有酯基,又可以银镜反应,应为甲酸形成的酯基;苯环上有两个位于间位的取代基,所以侧链为-Cl、-CH2OOCH,或-CH2Cl、OOCH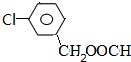 、
、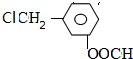 ,故答案为:
,故答案为: 、
、 ;
;


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、4.6g钠投入45.4g水中 |
| B、6.2g氧化钠投入42.2g水中 |
| C、7.8g过氧化钠投入42.2g水中 |
| D、8g烧碱投入42g水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
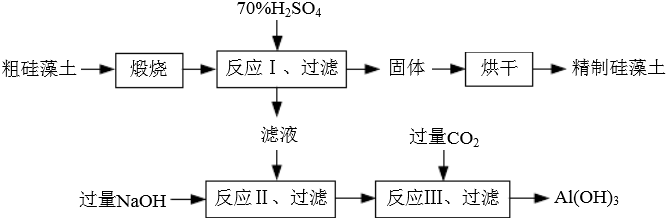
查看答案和解析>>
科目:高中化学 来源: 题型:
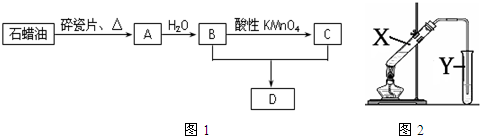
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、OH-、Cl-、NO3- |
| B、Fe2+、H+、Br+、NO3-、Cl- |
| C、Na+、NH4+、SO42-、NO3-、Cl- |
| D、Al3+、H+、Cl-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当H2与NH3生成速率为3:2时,反应一定达到平衡状态 |
| B、H2与N2的转化率一定相等 |
| C、c1一定等于0.14mol?L-1 |
| D、c3的取值范围为:0<c3<0.28mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(H+)=10-10mol?L-1的溶液中:Al3+、NH4+、Cl-、NO3- |
| B、pH值为1的溶液:Fe2+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12 mol?L-1的溶液:K+、HCO3-、Cl-、ClO- |
| D、pH值为13的溶液:K+、CO32-、Na+、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
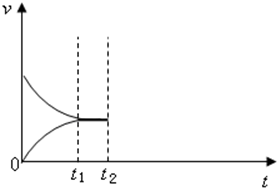 甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.
甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com