
 ,故答案为:
,故答案为: ;
;
| ||
| ||
| 33.6L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol铁与足量盐酸完全反应转移的电子数目为3NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
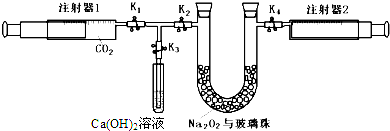
查看答案和解析>>
科目:高中化学 来源: 题型:
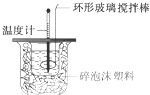 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |
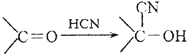
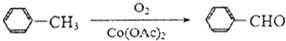
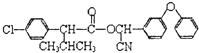 );
);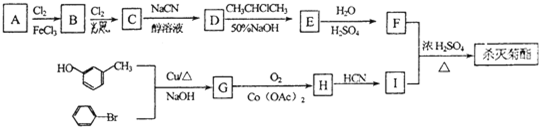
| H2O |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

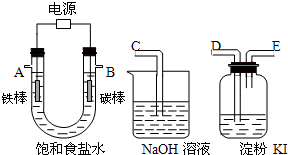
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com