
【题目】常温下已知:4Al(s)+3O2(g)═2Al2O3(s)△H1 , 4Fe(s)+3O2(g)═2Fe2O3(s)△H2;下面关于△H1、△H2的比较正确的是( )
A.△H1>△H2
B.△H1<△H2
C.△H1=△H2
D.无法计算
科目:高中化学 来源: 题型:
【题目】“瘦肉精”的结构简式可表示为: 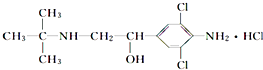
下列关于“瘦肉精”的说法中正确的是( )
A.摩尔质量为313.5 g
B.属于芳香烃
C.分子式为C12H19Cl3N2O
D.不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
B. 用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠溶液中可观察到有大量白色沉淀产生
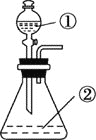
C. Al2O3和MgO均可与NaOH溶液反应
D. 在CO2中,Mg燃烧生成MgO和C在该反应条件下,Mg的还原性强于C的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。
(1)其中被还原的元素是________,被氧化的元素是_________,氧化剂是_________,还原剂是_________,氧化产物是_________,还原产物是__________。
(2)用双线桥标出电子转移的方向和数目:2KNO3+ 3C+ S ═ K2S + N2↑+ 3CO2↑________。
(3)当0.1molCO2生成时,则转移的电子数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和条件被略去,A、 X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;B、C、E是常见气体,G的焰色反应呈黄色;I的溶液呈黄色。

请回答下列问题:
(1)写出下列物质的化学式A___、F___;
(2)说出黄绿色气体C的一种用途___;
(3)实验室检验H中所含的金属阳离子的方法是,先加___无明显现象,再加氯水,溶液变为___色;
(4)写出C与H溶液反应的化学方程式___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 44g N2O含有的N原子数目为NA
B. 常温常压下,22.4 L N2含有的分子数目为NA
C. 1mol Mg变为Mg2+时失去的电子数目为2NA
D. 1L 1mol·L-1 K2CO3溶液中含有的 K+ 数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种重要的化工产品。某工厂用刻蚀印刷电路板产生的碱性废液[含较多[Cu(NH3)4]2+及少量Cu2+、NH4+、NH3和Cl-]制备硫酸铜晶体,流程如下:
(1)通过“中和、沉淀和过滤”可得碱式氯化铜[Cu(OH)Cl]固体,请将生成该固体的反应的离子方程式补充完整:[Cu(NH3)4]2+ +。
(2)制备Cu(OH)Cl沉淀时,溶液的pH对铜元素含量的影响如下图所示:
①若要提高Cu(OH)Cl沉淀的量,应将溶液的pH控制在(填字母序号)。
A. <5.2 B. 5.2~5.8 C. >5.8
②pH< 5.2 时,随pH减小,溶液中铜元素含量增大,其原因用反应的离子方程式可表示为。
(3)“化浆、酸化"过程可得到硫酸铜粗品,发生的反应为Cu(OH)Cl+ 4H2O+ H2SO4= CuSO4·5H2O+ HCl。则硫酸铜粗品中,含铜元素的杂质为 , 检验样品中含有该杂质的方法是:取少量硫酸铜粗品,加入适量水使其充分溶解,。
(4)硫酸铜粗品还需要通过重结晶法进行提纯,具体操作是:将粗晶体溶解于热水中形成饱和溶液,然后加入适量乙醇,搅拌,冷却,过滤并洗涤,得到高纯度的硫酸铜晶体。加入乙醇能够提高硫酸铜的产率,从溶解性角度解释其可能的原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几位同学分组对四种无色溶液分别进行离子检验,给出实验结果如下。你认为其中明显错误的是
A.K+、Ca2+、Cl-、NO3-B.Cu2+、NO3-、OH-、HCO3-
C.Na+、OH-、Cl-、CO32-D.Mg2+、K+、SO42-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com