
【题目】有关硅元素的下列叙述中正确的是( )
A. 常温时硅可和强碱及强酸溶液反应
B. 硅与任何酸都不反应
C. 硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
D. 硅的性质很稳定,能以游离态存在于自然界
科目:高中化学 来源: 题型:
【题目】中国营养学会修订颁布的“每日膳食营养素供给量”将硒(Se)列为15种每日膳食营养素之一,提出一个成年人每天对硒的适宜摄入量是50 ~250μg。回答下列有关问题:
(1) Se 原子的价电子排布式为_______,基态78 Se 原子中,核外存在______对自旋方向相反的电子。
(2)碱金属的硒化物溶液能够溶解硒,生成多硒化合物(M2Sex)。如多硒化钠Na2Se8,该物质中,化学键类型是________,Se原子之间形成的空间构型为_________________。
(3)As、S在元素周期表中均与Se 相邻,其氢化物分别是AsH3、H2Se和H2S其氢化物的稳定性强弱顺序为______________________。
(4)SeCl2和BeCl2均为1:2组成的分子,SeCl2中Se的轨道杂化类型是_______,BeCl2中Be的轨道杂化类型是_________________。
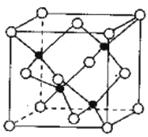
(5)Zn与Se同周期,S与Se同主族。由Zn与S形成的ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS晶胞结构如图所示,黑球代表的原子在晶胞内,白球代表的原子除在顶点外,其余的原子在晶胞_________ (填“内部”“棱上”或“面心”),若该晶体的密度为ρg·㎝-3,阿伏加德罗常数为NA mol-1,则立方晶胞的棱长=_____㎝(用含p、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铍元素及其化合物的性质的推测正确的是( )
A.铍原子的半径大于硼原子的半径
B.相同条件下,单质铍与酸反应比与单质锂与酸反应剧烈
C.氢氧化铍的碱性比氢氧化钙的碱性强
D.单质铍能与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小或不变
C.△H<0、△S<0的反应一定能自发进行
D.△H>0、△S<0的反应一定不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探宄海带中碘含量的测定和碘的制取。

已知:己知:3I2+6NaOH=5NaI+NaIO3+3H2O 请回答:
(1)实验中仪器的名称:A__________,B___________。
(2)①与②的操作名称__________________(填“相同”或“不相同”)
(3)步骤X为向海带原液中滴加0.0100mol/LAgNO3溶液,当海带原液中不再生成沉淀时,消耗 AgNO3溶液20.00mL,计算得海带中碘的百分含量为___________。
(4)步骤Y中,萃取后分液漏斗内观察到的现象是_____________________________________。
(5)方案甲中采用蒸馏不合理,理由是___________。
(6)下列有关步骤Z的说法,正确的是___________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C. NaOH溶液可以由乙醇代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Y | 地壳中含量最高的元素 |
Z | 存在质量数为23,中子数为12的核素 |
W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)R在元素周期表中的位置为______;X、Z、W三种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的催化氧化方程式为_______;B的结构式为_______;化合物Z2Y中存在的化学键类型为________。
(3)W溶于Z的最高价氧化物的水化物的离子方程式_______________。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为______。检验溶液中R3+常用的试剂是________,可以观察到的现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com