
【题目】下列关于铍元素及其化合物的性质的推测正确的是( )
A.铍原子的半径大于硼原子的半径
B.相同条件下,单质铍与酸反应比与单质锂与酸反应剧烈
C.氢氧化铍的碱性比氢氧化钙的碱性强
D.单质铍能与冷水剧烈反应
科目:高中化学 来源: 题型:
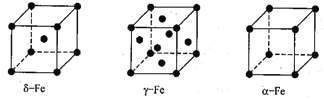
【题目】铁是最常见的金属材料。铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)〕 和Fe(CO)x等多种配合物。
(1)基态Fe3+的核外电子排布式为_____,与NO3-互为等电子体的分子是__________。
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式依次为______。C、N、O三种元素的第一电离能由大到小的顺序是______。
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______。Fe(CO)x常温下呈液态,熔点为-20 .5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。
(4)铁有δ、γ、a三种同素异形体,δ、γ、a三种晶胞中铁原子的配位数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
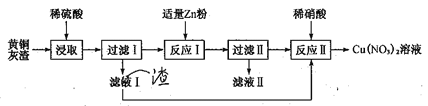
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
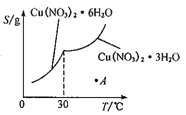
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增加。X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两元素对应的单质。若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中正确的是
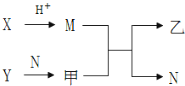
A. 相对分子质量M>N,沸点N>M
B. 常温常压下B的氢化物为气体,C的氢化物为固体
C. 原子半径:D>B>C>A
D. D的最高价氧化物的水合物为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 二氧化硫溶于水能导电,故二氧化硫属于电解质
B. 硫酸钡难溶于水,故硫酸钡属于弱电解质
C. 硫酸是强电解质,故纯硫酸能导电
D. 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下两种CH3COOH溶液a和b浓度分别为0.6mol/L和0.2mol/L,则a和b溶液中H+浓度之比为( )
A.小于3 B.大于3 C.等于3 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关硅元素的下列叙述中正确的是( )
A. 常温时硅可和强碱及强酸溶液反应
B. 硅与任何酸都不反应
C. 硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
D. 硅的性质很稳定,能以游离态存在于自然界
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A.BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B.KHSO4在熔融状态下可导电:KHSO4=K++H++SO42-
C.常温下,0.1mol/L的HF溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
D.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com