
【题目】用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
A. 漂白粉被空气中的氧气氧化了 B. 漂白粉在空气中生成了较多量的 HClO
C. 有色布条被空气中的氧气氧化了 D. 漂白粉溶液蒸发掉部分水,其浓度增大
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-l160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( 1) 的热化学方程式_________。
(2)已知: 反应I: 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H < 0
4NO(g)+6H2O(g) △H < 0
反应II: 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H < 0
2N2(g)+6H2O(g) △H < 0
①在恒温恒容装置中充入一定量的NH3 和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数) 增大
B.若测得容器内3v正(NH3)=2v逆(H2O) 时,说明反应已达平衡
C.升高温度,NH3 的转化率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在高温时选择反应_____(填“I”或“II”)。
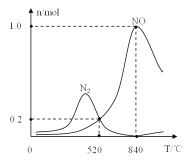
③520℃时,4NH3(g)+3O2 (g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
A.降低反应温度 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
(3)己知25℃时HCN 和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7× 10-11 |
25℃时,测得HCN 和NaCN 的混合溶液pH=11,则c(HCN)/c(CN-)=____。向NaCN 溶液中通入少量CO2,则发生反应的离子方程式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据物质的量相关计算填空
(1)19.6 g 硫酸是_____mol H2SO4 ,1.7 gNH3 在同温同压下与_____g H2S 气体含有的氢原子数相同。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,该气体的物质的量是_____,R 的相 对原子量为_____。
(3)已知 Wg 气体 A 含有 a 个分子,那么在标准状况下,bg 气体 A 所占的体积是 _____L (其中阿 伏加德罗常数用 NA 表示)
(4)标准状况下,密度为 0.75g/L 的 NH3 与 CH4 组成的混合气体中,NH3 的体积分数_______________, 混合气体的平均摩尔质量为_____, 该气体对氢气的相对密度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,成熟的工艺流程如下。
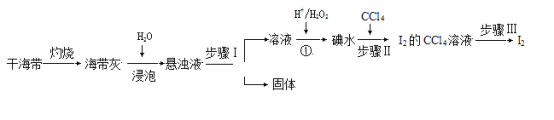
回答下列问题:
(1)实验室灼烧干海带通常在_____________中进行(填仪器名称)。
(2)步骤Ⅰ名称是____________,步骤Ⅲ名称是___________。
(3)验证反应①已经发生的实验操作是______________________________________________________。
(4)步骤Ⅱ中的CCl4能否改为乙醇,解释原因________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制450 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:

①胶头滴管,②烧瓶,③烧杯,④药匙,⑤量筒,⑥托盘天平。
请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的B和__________(填字母)。

(2)配制稀硫酸时,还缺少的仪器有_____________________________________(写仪器名称)。
(3)经计算,配制450 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL,量取硫酸时应选用____________规格的量筒。
A.10 mL B.50 mL C.100 mL D.200 mL
(4)在烧杯中稀释浓硫酸的实验操作为_______________________________________,若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为_____________________________。
(5)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因__________________(填序号)。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下表所示。X元素最常见价态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物。下列说法正确的是
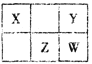
A. 简单离子半径:W>Z>Y
B. 简单气态氢化物的稳定性:Y >Z > W
C. 最高价氧化物对应的水化物酸性:W >Z
D. 若W的最高正价为+ m,则Y的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是

A. 溶液pH≤2时,生铁发生析氢腐蚀
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 析氢腐蚀和吸氧腐蚀的速率一样快
D. 两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Na2SO3+2H2O+I2=Na2SO4+2HI; ②Cl2+2Fe2+=2Fe3++2Cl-;③I2+Fe2+不反应,向含SO32-、Fe2+、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com