
【题目】请根据物质的量相关计算填空
(1)19.6 g 硫酸是_____mol H2SO4 ,1.7 gNH3 在同温同压下与_____g H2S 气体含有的氢原子数相同。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,该气体的物质的量是_____,R 的相 对原子量为_____。
(3)已知 Wg 气体 A 含有 a 个分子,那么在标准状况下,bg 气体 A 所占的体积是 _____L (其中阿 伏加德罗常数用 NA 表示)
(4)标准状况下,密度为 0.75g/L 的 NH3 与 CH4 组成的混合气体中,NH3 的体积分数_______________, 混合气体的平均摩尔质量为_____, 该气体对氢气的相对密度为__________________。
【答案】0.2 5.1 0.025 32 22.4ab/wNA 80% 16.8g/mol 8.4
【解析】
(1)硫酸的物质的量n=![]() ;而硫酸为7原子分子,据此计算硫酸中的原子的物质的量和个数;求出氨气的物质的量,然后根据氨气中含3个H原子来计算出其含有的H原子的物质的量,然后根据H2S中含2个H原子,求出H2S的物质的量,并根据质量m=nM来计算;
;而硫酸为7原子分子,据此计算硫酸中的原子的物质的量和个数;求出氨气的物质的量,然后根据氨气中含3个H原子来计算出其含有的H原子的物质的量,然后根据H2S中含2个H原子,求出H2S的物质的量,并根据质量m=nM来计算;
(2)根据其体积求出物质的量,然后根据摩尔质量M=![]() mn计算;而相对分子质量在数值上等于摩尔质量,故R的相对原子质量=相对分子质量-32;
mn计算;而相对分子质量在数值上等于摩尔质量,故R的相对原子质量=相对分子质量-32;
(3)Wg气体A含有a个分子,设bg气体含有的分子数为x个,则有:![]() =ax,解得x值;然后根据体积V=
=ax,解得x值;然后根据体积V=![]() Vm来计算体积;
Vm来计算体积;
(4)根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算混合气体中NH3和CH4的体积比.然后根据密度之比等于摩尔质量之比来计算。
(1)19.6 g 硫酸的物质的量n=![]() =
=![]() mol;
mol;
1.7g氨气的物质的量为n=![]() =0.1mol,而氨气中含3个H原子,故0.1mol氨气中含0.3molH原子,而H2S中含2个H原子,故含相同H原子数的H2S的物质的量为n=
=0.1mol,而氨气中含3个H原子,故0.1mol氨气中含0.3molH原子,而H2S中含2个H原子,故含相同H原子数的H2S的物质的量为n=
![]() =0.15mol,质量m=nM=0.15mol×34g/mol=5.1g;
=0.15mol,质量m=nM=0.15mol×34g/mol=5.1g;
(2) 标准状况下,Vm=222.4L/mol,1.6g某气态氧化物RO2的体积为0.56L,其物质的量为
![]() =0.025mol,其摩尔质量为
=0.025mol,其摩尔质量为![]() =64g/mol,故RO2的相对分子质量为64,则R的相对原子质量=64-16×2=32;
=64g/mol,故RO2的相对分子质量为64,则R的相对原子质量=64-16×2=32;
(3)已知 Wg 气体 A 含有 a 个分子,那么在标准状况下,bg 气体 A 所占的体积是 _____L (其中阿 伏加德罗常数用 NA 表示)
(4) 混合气体在标准状况下的密度为0.75g/L,
则混合气体的平均摩尔质量为0.75g/L×22.4L/mol=16.8g/mol,
根据十字交叉法计算混合气体中NH3和CH4的体积比:
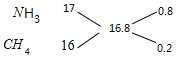
所以混合气体中NH3和CH4的体积比为0.8:0.2=4:1,
即氨气的体积分数=![]() ×100%=80%;
×100%=80%;
由于混合气体的平均摩尔质量为16.8g/mol,而氢气的摩尔质量为2g/mol,故混合气体对氢气的相对密度为![]() =8.4。
=8.4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能,乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。关于甲、乙的说法正确的是
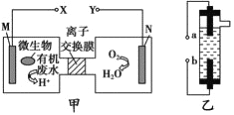
A. 装置乙中的b极要与装置甲的X极连接
B. 装置乙中a极的电极反应式为:2Cl- -2e-=Cl2↑
C. 当N极消耗5.6L(标准状况下)气体时,则有2NA个H+通过离子交换膜
D. 若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极反应为: C6H12O6+6H2O-24e-=6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 a L Al2(SO4)3 和(NH4)2SO4 的混合溶液分成两等份,向其中一份加入 b mol BaCl2,恰好使溶液中 的 SO42-完全沉淀;向另一份加入足量强碱并加热可得到 c mol NH3,则原溶液中 Al3+的浓度(mol/L)为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等质量铁与稀盐酸反应制备氢气时,欲使生成氢气的化学反应速率增大,下列措施可行的是( )
A.增加铁粒质量
B.换成同浓度的稀硫酸
C.改成98%的浓硫酸
D.加入纯硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出电子转移的方向和数目 ________。
(2)该反应中氧化剂与氧化产物物质的量之比是_____。
(3)由该反应判断, KMnO4 的氧化性比 Cl2 的氧化性(选填“强”或“弱”) ________。
(4)如反应中转移了 2mol 电子,则产生的 Cl2 在标准状况下体积为_____L 。
(5)某同学欲用 KMnO4 固体配制100mL 0.5mol/L 的溶液 。回答下列问题:
①配制 KMnO4 溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_____、_____。
②下列对容量瓶及其使用方法的描述中正确的是(请填序号)_____。
A.容量瓶上标有容积、温度和刻线
B.容量瓶用蒸馏水洗净后,必须加热烘干
C.配制溶液时,把量好的 KMnO4 固体小心放入容量瓶中,加入蒸馏水到接近刻度线 1~2 cm 处,改 用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是_______(请填序 号)
A.加水定容时俯视刻度线 B.容量瓶水洗后有水残留
C.颠倒摇匀后发现凹液面低于刻度线又加水补上 D.在溶解过程中有少量液体溅出烧杯外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对比甲烷和乙烯的燃烧反应,下列叙述中正确的是( )。
①二者燃烧时现象完全相同 ②点燃前都应验纯 ③甲烷燃烧的火焰呈淡蓝色,乙烯燃烧的火焰较明亮,并有大量黑烟生成 ④二者燃烧时都有黑烟生成
A.①②B.③④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
A. 漂白粉被空气中的氧气氧化了 B. 漂白粉在空气中生成了较多量的 HClO
C. 有色布条被空气中的氧气氧化了 D. 漂白粉溶液蒸发掉部分水,其浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.NaHCO3与NaOH溶液反应:HCO3-+OH-===CO32-+H2O
B.氯气和水反应:Cl2+H2O ![]() 2H++Clˉ+ClOˉ
2H++Clˉ+ClOˉ
C.氯化铁溶液中加入足量的氨水:Fe3+ + 3NH3·H2O = Fe(OH)3 ↓+ 3NH4+
D.盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-===SiO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的 CO2 质量进行 计算,某同学设计的实验装置示意图如下:
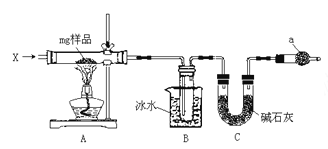
请回答:
(1)仪器 C 的名称是__________;
(2)装置 B 中冰水的作用是__________;
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验 过程中,下列因素可能使碳酸钠的质量分数偏高的是__________。
A.样品分解不完全
B.装置 B、C 之间缺少 CO2 的干燥装置
C.产生 CO2 气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com