
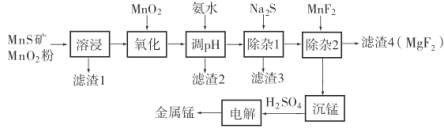
【题目】锰不仅在工业上用途广泛,还是人体内必需的微量元素,对人体健康起着重要的作用。一种以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备金属锰的流程如图所示。请回答下列问题:
相关金属离子![]() 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
|
|
|
开始沉淀pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中需加入的试剂是________(填化学式)。
(2)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。
(3)“滤渣2”的主要成分是________________________________(填化学式)。
(4)![]() 可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
(5)“沉锰”得到![]() 沉淀,写出该反应的离子方程式________________。
沉淀,写出该反应的离子方程式________________。
(6)电解硫酸锰溶液制备单质锰时,阴极的电极反应为________;电解后的电解质溶液可返回________工序继续使用。
【答案】![]() 4.7
4.7 ![]() 、
、![]()
![]()
![]()
![]() 溶浸
溶浸
【解析】
天然二氧化锰粉与硫化锰矿与硫酸反应,过滤出不溶于硫酸的物质,再加二氧化锰氧化亚铁离子,再加氨水调节溶液的pH除掉铝离子和铁离子,再加硫化钠除掉镍离子和锌离子,过滤,向滤液中加入氟化锰除掉镁离子,过滤,再加碳酸氢铵沉锰,得到碳酸锰,碳酸锰加硫酸反应生成硫酸锰,再电解得到锰和硫酸,硫酸反复使用。
(1)根据后面沉锰时加硫酸,因此再“溶浸”中需加入的试剂是硫酸;故答案为:H2SO4。
(2)“调pH”除铁和铝,将铝离子生成沉淀,完全沉淀pH为4.7,因此溶液的pH范围应调节为4.7~6之间;故答案为:4.7。
(3) 调节为4.7~6之间,因此“滤渣2”的主要成分是![]() 、
、![]() ;故答案为:
;故答案为:![]() 、
、![]() 。
。
(4)![]() 可做“沉锰”试剂,该物质的水溶液呈碱性,说明碳酸氢根水解程度大于铵根水解程度,因此溶液中离子浓度由大到小的顺序为
可做“沉锰”试剂,该物质的水溶液呈碱性,说明碳酸氢根水解程度大于铵根水解程度,因此溶液中离子浓度由大到小的顺序为![]() ;故答案为:
;故答案为:![]() 。
。
(5)“沉锰”是锰离子和碳酸氢根反应生成![]() 沉淀、二氧化碳和水,其反应的离子方程式
沉淀、二氧化碳和水,其反应的离子方程式![]() ;故答案为:
;故答案为:![]() 。
。
(6)电解硫酸锰溶液制备单质锰时,阴极是锰离子得到电子,其电极反应为![]() ;阳极得到硫酸,因此电解后的电解质溶液可返回溶浸工序继续使用;故答案为:
;阳极得到硫酸,因此电解后的电解质溶液可返回溶浸工序继续使用;故答案为:![]() ;溶浸。
;溶浸。


科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2-氯丁烷与乙醇溶液共热发生消去分子的反应
C. 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D. 邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三位化学家因研究锂电池做出开创性贡献而获得2019年诺贝尔化学奖。磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点;成为目前广泛使用的锂电池。
(1)铁元素在元素周期表中的位置__;LiFePO4中Fe2+基态电子排布式是__。
(2)P的电负性___O的电负性(填写“大于”“小于”或“等于”);PO43-的空间构型是__,中心原子的杂化方式是___。
(3)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是__。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为__,其中Fe的配位数为__。
(5)有一种蓝色晶体[可表示为:KFex(CN)6,相对分子质量为Mr],经研究发现,其晶胞的![]() 如图所示(K+未画出)。
如图所示(K+未画出)。
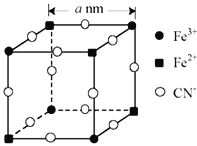
①晶体中与每个Fe3+距离最近且等距离的CN-有__个。
②该晶体的化学式为__。
③若晶胞中每个Fe3+和Fe2+距离用anm表示,则晶体的密度表达式是__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
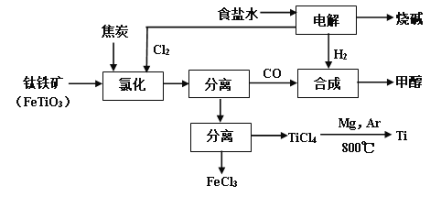
【题目】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。
已知:合成甲醇的主反应为:CO+2H2![]() CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2![]() C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2![]() C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________(填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________。
(3)诸如上述联合生产,其优点有_______。生产中除了获得上述目标产品外,还能得到副产品________(填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2 _____吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
物质 | 沸点(0C) |
TiCl4 | 136 |
FeCl3 | 315 |
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() ,该反应在不同温度下的平衡常数见表。下列说法正确的是( )
,该反应在不同温度下的平衡常数见表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A.平衡后温度不变缩小容器容积,![]() 的转化率升高
的转化率升高
B.增加高炉的高度可以有效降低炼铁尾气中CO的含量
C.其他条件不变时,增大c(CO),该反应的K值增大
D.由表中数据可判断该反应:反应物总能量大于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用![]() 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为![]() ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量![]() 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物![]() ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用![]() 的
的![]() 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为![]() 。消耗标准
。消耗标准![]() 溶液的体积如表所示。
溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 1.10 | 1.50 | 2.40 |
滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________。
(2)![]() 标准液应装在________(填“酸式”“碱式”)滴定管中。
标准液应装在________(填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________,判断达到滴定终点的现象是________。
(4)气体样品中CO的体积分数为________(已知气体样品中其他成分不与![]() 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3(含少量FeO、Fe2O3、SiO2)。某小组同学在实验室以孔雀石为原料制备胆矾,并测定所得胆矾中结晶水的含量。实验步骤如下:
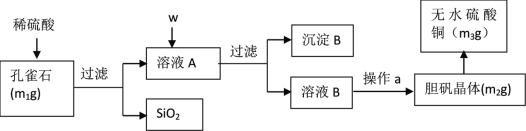
(提供试剂:NaOH溶液、 H2O2溶液、 CuO 、Na2CO3)
完成下列填空:
(1)孔雀石的主要成分与稀硫酸反应的离子方程式为________。
(2)按试剂加入顺序,w所代表的试剂依次为__________。沉淀B的成分为_______。
(3)a操作依次为:加热蒸发、_______、过滤、洗涤、__________。除烧杯、漏斗之外过滤还需要另一玻璃仪器,该仪器在此操作中的主要作用是_________。
(4)欲检验溶液A中Fe2+的试剂是___________(选填序号)。如果测定Fe2+的含量,需要用容量瓶配制某标准溶液,请简述配制中“定容”的操作:_____。
a NaOH(aq) b Na2CO3(aq) c 淀粉KI(aq) d 酸性KMnO4(aq)
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果的实验误差为1.5%,可能的原因是_______________。
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中孔雀石的质量分数为: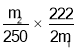 ,另一位同学不同意,其原因是___________。
,另一位同学不同意,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是

A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com