
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183 kJ/mol
2NO(g) ΔH = +183 kJ/mol
2H2(g) + O2(g) === 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) === 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = ___________ kJ/mol
2NH3(g) ΔH = ___________ kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
① 按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=_________________(只需代入数据,不用计算结果)
② 按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式:________________________

【答案】-92.2BC0.82/(1.83×0.6)逆向4NH3 -12e- +12OH- =2N2+12H2O
【解析】试题分析:(1)根据盖斯定律计算;
(2)根据平衡状态的含义分析解答;
(3)根据平衡常数的概念计算;依据等效平衡分析;
(4)根据原电池工作原理解答。
解析:(1)已知25℃时:①N2(g) + O2(g) ![]() 2NO(g) ΔH = +183 kJ/mol
2NO(g) ΔH = +183 kJ/mol
②2H2(g) + O2(g) =2H2O(l) ΔH = -571.6 kJ/mol
③4NH3(g) + 5O2(g) =4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 根据盖斯定律①+②×3/2-1/2×③即得到N2(g) + 3H2(g) ![]() 2NH3(g) ΔH =-92.2kJ/mol;
2NH3(g) ΔH =-92.2kJ/mol;
(2)A.容器内N2、H2、NH3的浓度之比为1︰3︰2并不能说明正逆反应速率相等,则不一定达到平衡状态,A错误;B.3v(N2)正=v(H2)逆表示正逆反应速率相等,达到平衡状态,B正确;C.正反应体积减小,容器内压强保持不变 说明反应达到平衡状态,C正确;D.生成1mol N2的同时消耗2molNH3均表示逆反应速率,不能说明反应达到平衡状态,D错误,答案爱信BC。
(3)① N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L) 1 3 0
转化浓度(mol/L)0.4 1.2 0.8
平衡浓度(mol/L)0.6 1.8 0.8
因为合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积,所以该反应的平衡常数表达式为K=c2(NH3) /c3(H2)c(N2)=0.82/(1.83×0.6);
②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应,起始时反应进行的方向为逆向;
(4)Pt电极通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原发生还原反应。负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3 -6e- +6OH-=N2+6H2O。


科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
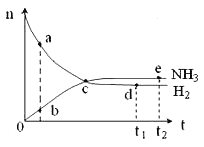
A. 点a的n(H2)和点b的n(NH3)比值为3∶2
B. 点 c处反应达到平衡
C. 点d (t1时刻)和点 e (t2时刻) 处n(N2)不一样
D. 其他条件不变,773K下反应至t1时刻,n(H2)比右图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
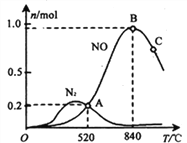
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
② 52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③ C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢
硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金与铁的物理性质的比较如下表所示:
性质 种类 | 熔点 | 密度 | 硬度 | 导电性 |
某合金 | 3 200℃ | 3.20 g/cm3 | 7.5 | 3.5 |
铁 | 1 535℃ | 7.86 g/cm3 | 4.5 | 17 |
(注:硬度以金刚石为10作标准,导电性以银的导电性100为标准)
已知该合金耐腐蚀、强度大,从性能看,该合金不适合制
A. 门窗框B. 炉具
C. 导线D. 飞机外壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.2 g D![]() O中含有的质子数、中子数、电子数均为NA
O中含有的质子数、中子数、电子数均为NA
B.80 g CuO和Cu2S的混合物中含有的铜原子数一定为NA
C.标准状况下,5.6 L O2作氧化剂时转移电子数一定为NA
D.500 mL 2 mol·L-1 Na2CO3溶液中含C微粒总数一定为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式书写或离子共存说法正确的是
A.在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,![]() =0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq) ![]() SO42-(aq)+CaCO3(s)
SO42-(aq)+CaCO3(s)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的⑩种元素,用元素符号或化学式回答相关问题:

(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为______________。
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是_________。
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为_______________________。
⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为_______________________。
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为_____________。
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式________________________。
(6)写出下列物质的电子式:
①形成的单质______;
⑥与⑩形成的物质________;
用电子式表示④与⑦所组成物质的形成过程___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com