
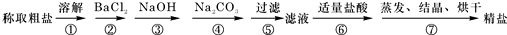


科目:高中化学 来源:2012-2013学年江西省南昌市第二中学高一第一次月考化学试卷(带解析) 题型:实验题
(11分)(1)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):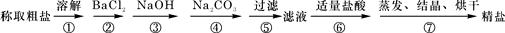
①第5步实验操作需要烧杯、____________、___________玻璃仪器。
②步骤2中,判断加入BaCl2已过量的方法是:
。
③除杂试剂BaCl2、NaOH、Na2CO3加入的顺序必须满足 。
④若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
(2)为检验粗盐溶液中Cl-、SO42-请根据内容填空:
①首先检验 离子,应先加入过量的 。
②将所得混合物过滤,然后在溶液中加入试剂 检验另一离子。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:填空题
以食盐为原料进行生产并综合利用的某些过程如下图所示:

(1)为除去粗盐中的Ca2+、Mg2+和SO ,得到纯净的NaCl晶体,需加入以下试剂:A.过量的NaOH溶液;B.过量的Na2CO3溶液;C.适量的盐酸;D.过量的BaCl2溶液。
,得到纯净的NaCl晶体,需加入以下试剂:A.过量的NaOH溶液;B.过量的Na2CO3溶液;C.适量的盐酸;D.过量的BaCl2溶液。
正确的加入顺序是_______,还缺少的操作步骤是__________和___________。
(2)将滤液的pH调至酸性除去的离子是________,发生反应的离子方程式为________。
(3)若用惰性电极电解200mL1.5mol/L食盐水,当电解2min时,两极共收集到448mL气体(标准状况下)。假设电解前后溶液的体积不变,则电解后该溶液的pH为______。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是___________。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)_____________。
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。则反应前的溶液中与反应后的滤液中水电离出的 (OH-)的比值是_________。
(OH-)的比值是_________。
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高一第一次月考化学试卷(解析版) 题型:实验题
(11分)(1)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
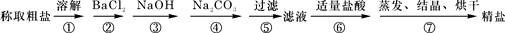
①第5步实验操作需要烧杯、____________、___________玻璃仪器。
②步骤2中,判断加入BaCl2已过量的方法是:
。
③除杂试剂BaCl2、NaOH、Na2CO3加入的顺序必须满足 。
④若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
(2)为检验粗盐溶液中Cl-、SO42-请根据内容填空:
①首先检验 离子,应先加入过量的 。
②将所得混合物过滤,然后在溶液中加入试剂 检验另一离子。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三上学期第二次月考化学卷 题型:选择题
在电解食盐水之前,需要提纯食盐水。(1)为除去粗盐中的Ca2+.Mg2+.SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④③①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com